题目内容
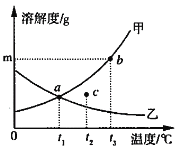
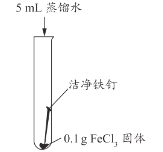
【题目】如图表示实验室用稀H2SO4、CuO、Fe粉三种物质,制取铜的两种实验方案。

(1)若按方案1制取铜,步骤I的反应类型是_____。步骤II反应的现象是_____;
(2)若按方案2制取铜,步骤I发生反应的化学方程式_____,步骤II的实验操作中需要的玻璃仪器有玻璃棒、烧杯和_____。
(3)两种方案比较,方案_____更好,理由是:_____。
【答案】置换反应 黑色粉末逐渐变红,有水珠出现 CuO+H2SO4 ═CuSO4+H2O 漏斗 II 安全、节能
【解析】
(1)步骤I是铁与硫酸反应生成硫酸亚铁溶液和氢气,步骤II是氢气与氧化铜反应生成铜和二氧化碳,进行分析解答。
(2)步骤I是氧化铜与硫酸反应生成硫酸铜和水,进行分析解答。
(3)根据反应条件、操作是否安全方便等,进行分析解答。
(1)步骤I是铁与硫酸反应生成硫酸亚铁溶液和氢气,该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应。
步骤II是氢气与氧化铜反应生成铜和二氧化碳,步骤II反应的现象是黑色粉末逐渐变红,有水珠出现。
(2)步骤I是氧化铜与硫酸反应生成硫酸铜和水,反应的化学方程式为:CuO+H2SO4═CuSO4+H2O。
步骤II的实验操作是过滤,步骤II的实验操作中需要的玻璃仪器有玻璃棒、烧杯和漏斗。
(3)方案1中氢气与氧化铜反应需进行加热,两种方案比较,方案II更好,理由是安全、节能。

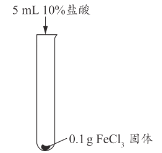
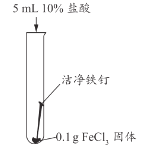
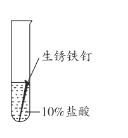
【题目】兴趣小组用稀盐酸除去铁钉表面的铁锈(主要成分是Fe2O3),发现反应开始时铁锈消失,有气泡产生,溶液颜色为黄色,一段时间后变为浅绿色。
(查阅资料)FeCl3的溶液呈黄色
甲同学认为生成的FeCl3可能与试管中的物质继续反应,进行了下列实验。
实验编号 | 实验1-1 | 实验1-2 | 实验1-3 |
实验操作 |
|
|
|
实验现象 | 长时间放置,溶液颜色始终为黄色 | 长时间放置,溶液逐渐从黄色变浅绿色 | 长时间放置,产生红褐色沉淀 |
(1)用盐酸除铁锈的化学方程式为_________。
(2)实验1-1的目的是_________。
(3)综合分析实验1,溶液从黄色变浅绿色的可能原因是_________。
乙同学用生锈程度相同的锈铁钉、5mL盐酸探究溶液颜色变化的影响因素。
实验编号 | 所用试剂 | 实验现象 | |
反应开始时 | 24h后 | ||
2-1 | 铁锈和2%盐酸 | 铁锈、溶液均无明显变化 | 铁锈消失,溶液变黄色 |
2-2 | 生锈铁钉和2%盐酸 | 生锈铁钉、溶液均无明显变化 | 铁锈消失,溶液变浅绿色 |
23 | 生锈铁钉和6%盐酸 | 铁钉表面有少量气泡,铁锈逐渐消失,溶液逐渐由无色变浅黄色 | 溶液变为浅绿色 |
2-4 | 生锈铁钉和10%盐酸 | 铁钉表面产生大量气泡,铁锈逐渐消失,溶液很快由无色变黄色 | 溶液变为浅绿色 |
(4)生锈铁钉与盐酸反应时,溶液的颜色变化与________有关。
(5)2-2中始终未观察到溶液变黄色,结合实验1和实验2推测可能的原因为______。
(6)基于上述实验推测,下列关于工业用盐酸除铁锈的说法合理的是______(填字母 序号)。
A 除铁锈时,所用盐酸的浓度越大越好
B 在除锈过程中,生成的FeCl3对铁也有腐蚀作用
C 用盐酸除锈时,应注意控制反应的时间
【题目】有一包固体粉末,其中含有碳酸钠、氢氧化钠、碳酸钙、生石灰、氯化钠中的四种物质。某兴趣小组为确定其组成设计并进行如下实验。
(实验一)甲组同学进行如下探究。请完成表中空白。
实验操作 | 实验现象 | 实验结论及分析 |
Ⅰ.取少量该固体粉末于烧杯中,加入足量的水溶解、过滤 | 粉末部分溶解,得到白色滤渣和无色滤液 | 滤渣中一定含有_____ |
Ⅱ.向滤液中滴加无色酚酞试液 | 溶液变红 | 滤液中可能含有_____物质(填“酸性”“碱性”或“中性”) |
Ⅲ.向Ⅱ中所得溶液滴加足量稀盐酸 | _____ | 原固体粉末中一定含有Na2CO3 |
(实验二)乙组同学进行如下探究。
取21.0g该固体粉末,加入160.0g 10%的稀盐酸,恰好完全反应,实验测得产生8.8g二氧化碳,将反应后溶液继续蒸发结晶,得到固体,测定所得固体中含16.0g氯元素。
试综合甲、乙两组同学的实验进行分析,填空:
(1)乙组实验中一定发生的化学反应是:Na2CO3+2HCl═2NaCl+H2O+CO2↑
(2)固体粉末的组成中除Na2CO3外,一定还含有的物质是_____,可能含有的物质是_____(均填写化学式)