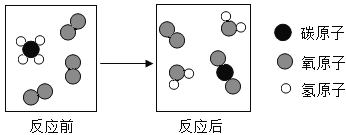
��Ŀ����
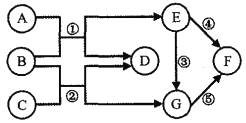
����Ŀ��A��G �dz��л�ѧ���������ʣ�����֮���ת����ϵ��ͼ��ʾ������ A��B�� C��D ���������E��F��G ���ǽ������ʣ��� F Ϊ�����ԡ���������õĽ�����A �� G ��Ϊ��ɫ����(���в��ַ�Ӧ��������Ӧ�P����������ȥ)����ش���������:
��1��д�� G ���ʵĻ�ѧʽ____��
��2��д�� B ���ʵ�һ����;____��
��3��д���ٷ�Ӧ�Ļ�ѧ����ʽ_______�� д���ڷ�Ӧ�Ļ�ѧ����ʽ____��
��4�����۽ǶȽ��� B �� D �����������ʲ�ͬ��ԭ��____��
���𰸡�Cu ұ����������ȼ�� 3CO+Fe2O3![]() 2Fe+3CO2 CO+CuO
2Fe+3CO2 CO+CuO![]() Cu+CO2 ���ӹ��ɲ�ͬ
Cu+CO2 ���ӹ��ɲ�ͬ
��������
��1��A��G�dz��л�ѧ���������ʣ�����A��B��C��D���������E��F��G���ǽ������ʣ���FΪ�����ԡ���������õĽ���������F������A��G��Ϊ��ɫ���壬G��ת������������G��ͭ��A��B���ɵ�E����ת����ͭ������A����������B��һ����̼��һ����̼��C��Ӧ������ͭ������C������ͭ��D�Ƕ�����̼��������֤���Ƶ���ȷ������G��Cu��
��2��B��һ����̼����;��ұ����ȼ����
��3����Ӧ��һ����̼���������ڸ��µ��������������Ͷ�����̼����ѧ����ʽ�ǣ�3CO+Fe2O3![]() 2Fe+3CO2����Ӧ����һ����̼������ͭ�ڼ��ȵ�����������ͭ�Ͷ�����̼����ѧ����ʽ�ǣ�CO+CuO
2Fe+3CO2����Ӧ����һ����̼������ͭ�ڼ��ȵ�����������ͭ�Ͷ�����̼����ѧ����ʽ�ǣ�CO+CuO![]() Cu+CO2��
Cu+CO2��
��4�����۽ǶȽ���B��D�����������ʲ�ͬ��ԭ���ǣ����ӹ��ɲ�ͬ��1��������̼��CO2�����ӱ�1��һ����̼��CO�����Ӷ�1����ԭ�ӡ�

 ����ѧУ�ֲ����ܲ�ϵ�д�
����ѧУ�ֲ����ܲ�ϵ�д� �ƸԺ���ȫ�����Ų��Ծ�ϵ�д�
�ƸԺ���ȫ�����Ų��Ծ�ϵ�д�����Ŀ����ѧʵ���ҳ��ö������̴���������ֽ�ķ�����ȡ��������ô,Ӱ���������ֽ���������ص�������Щ��?ij��ѧ��ȤС��Դ˽��������о���
��������⣩Ӱ���������ֽ��������������Щ?
����������裩����1:����������Һ��Ũ��;
����2:����������;
����3:�¶�;
����4:_______��
�����ʵ�飩С��ͬѧ�������ʵ�鷽��������֤��
��� | H2O2��Һ��Ũ�� | H2O2��Һ������ | �¶� | MnO2������ | �ռ�O2����� | ʱ�� |
�� | 5% | 12 g | 20 �� | 0.2 g | 125 mL | 20 s |
�� | 30% | 12 g | 20 �� | 0.2 g | 125 mL | 2 s |
�� | 30% | 12 g | 40 �� | �� | 125 mL | 148 s |
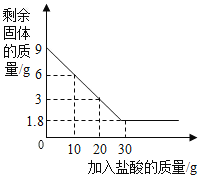
��1��ͨ���Ա�ʵ��ٺ͢ڿ�֪,��������ֽ�Ŀ�����_______�йء�
��2���ڹ�������ֽ�ǰ��,�������̵�������_______���䡣
��3������д���ö������̴���������ֽ�Ļ�ѧ����ʽ:_______��
�����۽�������4��С��ͬѧ��Ϊ�����ʵ����,��������ˮ���ռ�����,������_______��
��5��С��ͬѧ���С���ķ�������֤�¶ȶԹ�������ֽ������Ӱ��,�������˵������:____��
����չ���죩ͬѧ�Dz������ϵ�֪,FeCl3��Һ�Թ�������ֽ�Ҳ��Ӱ�졣����ʦ��ָ�������ʵ�����̽��,����֧�Թ��зֱ�������������ͬŨ�ȵ�H2O2��Һ,�ټ������������Ũ�ȵ�FeCl3��Һ,�ֱ�����ѹ�������ⶨ���Թ�������ѹ���ı仯����,��ͼ1��
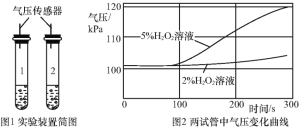
��6��Ϊ��֤ʵ���ȷ��,������������Թ��м���FeCl3��Һ�ľ��巽��:__��
��7�������ͼ2�������ҳ�FeCl3��Һ��H2O2�ֽ�Ӱ������������Խ���:__��____��