题目内容
【题目】如图为某反应的微观示意图,其中“![]() ”和“
”和“![]() ”表示不同元素的原子。下列说法正确的是
”表示不同元素的原子。下列说法正确的是
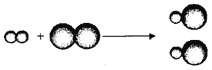
A. 反应前后元素的种类发生改变
B. 反应前后分子种类没有改变
C. 该反应属于置换反应
D. 参加反应的两种分子个数比为1:1
【答案】D
【解析】
A. 元素是质子数相同的同一类原子的总称,由题中信息可知,反应前后原子的类别没变,反应前后元素的种类不发生改变,选项错误;
B. 由图中信息可知,反应前后分子种类发生改变,选项错误;
C. 置换反应是由一种单质和一种化合物生成另一种单质和另一种化合物的反应,该反应不属于置换反应,选项错误;
D. 据质量守恒定律可知反应前后原子的种类、个数不变,所以参加反应的两种分子个数比为1:1,选项正确。故选D。

【题目】某化学兴趣小组在探究物质燃烧条件时,做了如下实验:
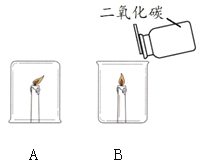
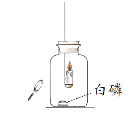
同学们发现两支蜡烛都熄灭了。
(提出问题)实验A中蜡烛熄灭的原因是什么?
(猜想与假设)
猜想1:烧杯内的氧气被耗尽,所以蜡烛熄灭。
猜想2:烧杯内的二氧化碳含量升高,所以蜡烛熄灭。
(进行实验)
实验I:点燃蜡烛,塞紧胶塞。待蜡烛熄灭后,用放大镜照射白磷。观察到白磷燃烧。
实验II:经检测,实验A中,蜡烛熄灭时,烧杯内二氧化碳的体积分数约为3%。在集气瓶中按照一定的体积比收集气体,分别放入燃烧的蜡烛和燃烧的红磷,实验记录如下:
V(O2):V(CO2) | 蜡烛 | 红磷 |
1:4 | 燃烧 | 燃烧 |
1:5 | 燃烧 | 燃烧 |
1:6 | 熄灭 | 燃烧 |
1:9 | 熄灭 | 燃烧 |
(解释与结论)
(1)实验B中蜡烛熄灭,体现二氧化碳的化学性质是_______。
(2)实验I的目的是_______。
(3)写出红磷燃烧的化学方程式_______。
(4)实验II证明猜想2错误,依据的实验现象是_______。
(5)结合实验I与实验II,得出的实验结论是_______。
(实验反思)
(6)通过此实验,同学们对物质燃烧的条件有了新的认识,如_______。
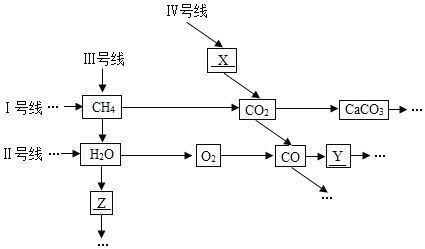
【题目】在宏观、微观和符号之间建立联系是化学学科的特点。高温下,甲和乙反应生成丙和丁,结合表中信息判断下列说法正确的是
物质 | 甲 | 乙 | 丙 | 丁 |
|
化学式 | ? | C | CO | H2 | |
微观 示意图 |
|
|
| ? |
A. 甲的化学式为CO2 B. 保持丙化学性质的最小粒子为碳原子和氧原子
C. 反应物和生成物中都有化合物 D. 反应生成丙与丁的分子个数比为2:1
【题目】在一密闭容器中,物质X不完全燃烧时可以产生一氧化碳、二氧化碳和水。依据下表数据分析得出的结论中,正确的是
物质 | X | 氧气 | 二氧化碳 | 水 | 一氧化碳 |
反应前质量/g | 6.6 | 8.8 | 0 | 0 | 0 |
反应后质量/g | 2 | 0 | 6.6 | 5.4 | a |
A. X中碳元素的质量分数为52.2% B. X中只含有C、H两种元素
C. 表中a的值为3.4 D. 无法确定X中是否含有氧元素
【题目】水是生命之源,人类的生产、生活都离不开水。
(1)自然界中的水含有许多可溶性和不溶性杂质。长期饮用硬水可能会引起体内结石,生活中常用____________的方法来降低水的硬度。
(2)水是常用的溶剂,配制下列溶液时,以水做溶剂的是_______(填序号)。
A.生理盐水 B.医用碘酒 C.高锰酸钾溶液 D.医用酒精
(3)下表是NaCl、KNO3在不同温度时的溶解度
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
①根据表中的数据,在坐标纸上绘制出氯化钠和硝酸钾两种物质的溶解度曲线。(请用铅笔在答题卡的坐标纸上绘图)________
②根据绘制的氯化钠和硝酸钾的溶解度曲线判断,温度大约在_____℃时,两种物质的溶解度大小相等。
③现有氯化钠和硝酸钾各40g ,30℃时,分别加入两只盛有100g水的烧杯中,能得到饱和溶液的是______(填溶质名称), 将上述得到的不饱和溶液转化为该温度下的饱和溶液,可采用的方法是_____。
④在60℃时,硝酸钾的溶解度是110g。这句话的含义是______。
(4)以太阳能为热源,经由铁氧化合物循环分解水的过程如右图所示:
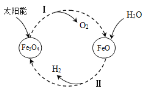
① 写出在一定条件下发生的反应Ⅱ的化学方程式______。
② 在上述循环过程中,最终得到的产品是________。
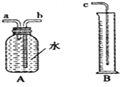
【题目】小敏研究影响锌与盐酸反应快慢的因素。
序号 | 盐酸溶液浓度 | 2分钟内产生氢气的体积 |
1 | 5% | 10mL |
2 | 15% | 28mL |
(1)写出该反应的化学方程式。
(2)图中A、B仪器可以组装一套测量气体体积的装置,利用该装置时A中的_____(a或b)管接c。
(3)他选用2克完全相同的锌片分别和同体积5%、15%的稀盐酸进行实验。获得表格数据。由此推断实验是通过_________来体现反应快慢的。
(4)小敏分析数据得到如下结论:锌与盐酸反应快慢与盐酸浓度有关,盐酸浓度越大反应越快。其他同学认为结论不可靠,他们的依据是:______________。
(5)实验中小敏发现锌与盐酸反应时,一开始产生氢气速度并没有随盐酸浓度的减少而减慢,查阅资料得知化学反应中往往伴随着能量变化。由此作出猜想:锌与盐酸反应快慢还与_______有关。