题目内容
【题目】小敏研究影响锌与盐酸反应快慢的因素。
序号 | 盐酸溶液浓度 | 2分钟内产生氢气的体积 |
1 | 5% | 10mL |
2 | 15% | 28mL |
(1)写出该反应的化学方程式。
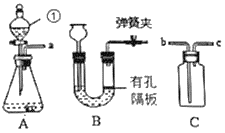
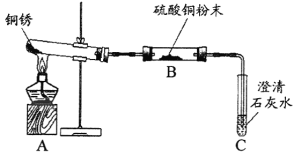
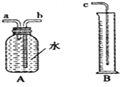
(2)图中A、B仪器可以组装一套测量气体体积的装置,利用该装置时A中的_____(a或b)管接c。
(3)他选用2克完全相同的锌片分别和同体积5%、15%的稀盐酸进行实验。获得表格数据。由此推断实验是通过_________来体现反应快慢的。
(4)小敏分析数据得到如下结论:锌与盐酸反应快慢与盐酸浓度有关,盐酸浓度越大反应越快。其他同学认为结论不可靠,他们的依据是:______________。
(5)实验中小敏发现锌与盐酸反应时,一开始产生氢气速度并没有随盐酸浓度的减少而减慢,查阅资料得知化学反应中往往伴随着能量变化。由此作出猜想:锌与盐酸反应快慢还与_______有关。
【答案】Zn+2HCl==ZnCl2+ H2↑ b 相同时间内产生气体多少 没有换用不同浓度盐酸多次实验等(5)温度
【解析】
(1)锌和盐酸反应生成氯化锌和氢气,该反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑;
(2)氢气的密度小于水。图中A、B仪器可以组装一套测量气体体积的装置,利用该装置时A中的b管接c,排入量筒中水的体积即为收集的气体体积;
(3)由此推断实验是通过相同时间内排入量筒中水的体积(即相同时间内产生气体多少)来体现反应快慢的;
(4)其他同学认为结论不可靠,他们的依据是没有换用不同浓度盐酸多次实验等;
(5)锌和盐酸反应放热,由此作出猜想:锌与盐酸反应快慢还与温度有关,即温度越高,反应速率越快。

练习册系列答案
相关题目