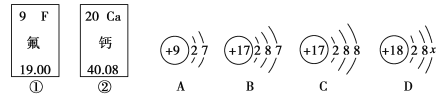��Ŀ����
����Ŀ���������ִ������ҵ������Ӧ�ü�Ϊ�ձ��һ����ϡ�
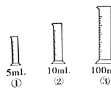
��һ����֪����ͬ�������£������Ļ��Խǿ���������ᷴӦ�������ݣ����������ٶȾ�Խ�졣Al��Cu��Fe���ֽ�����ϡ������ķ�Ӧ������ͼ1��ʾ��

��1��ͼ1��Y�������Ľ�����_____���Cu����Fe������
��2��Al��Cu��Fe���ֽ����Ļ����ǿ������˳��Ϊ_____��
��3������һ�ֻ��ý���������������ȴ�н�ǿ�Ŀ���ʴ�ԣ���ԭ����_____�����÷���ʽ��ʾ��ѧԭ����
��������ֹ������ʴ���ر��Ǹ�������ʴ�������ѧ�о��ͼ��������е��ش����⡣�����������Ϊ����_____��_____ ͬʱ�Ӵ���_____����һ�����ʣ��ɼ���������ʴ��Ϊ�˷�ֹ����Ʒ���⣬Ӧ��ȡ�Ĵ�ʩ��_____��д��һ�֣���
���������ϣ�����ɷָ��ӣ���ѧʽ�ɼ�ʾΪFe2O3nH2O��Ũ���������ˮ����ʯ�ҿ�������ˮ�Ͷ�����̼��
��������⣩���⣨Fe2O3nH2O����n��ֵ���ڶ����أ�
������̽����С������ʵ��������һ���ܲ��Ƶ����ۣ����Ѿ����ɺ��ɫ��Ϊ��̽�����⣨Fe2O3nH2O������ɣ���ȡ27.0g����������Ʒ������ͼ2��ʾװ�ý���ʵ�顣
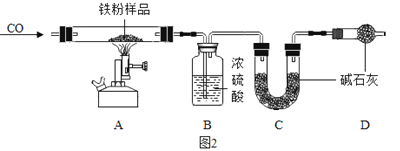
��4��ʵ��ǰӦ��______��
��5��Ϊ�˱�֤ʵ�鰲ȫ��ʵ�鿪ʼʱӦ��_____��Ŀ����_____��
��6��A�е�������_____����ָ����װ������һ�����Բ���_____��
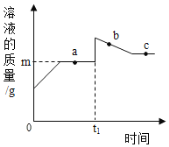
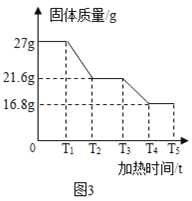
�����ݴ�����ͼ3�Ǽ���ʱ���A�й���������ϵͼ���±���B��C���������ٱ仯ʱB��Ũ���ᡢC�м�ʯ��װ�������仯�����
��Ӧǰ��g�� | ��Ӧ��g�� | |
B | 100 | 105.4 |
C | 150 | 163.2 |
��7��д��T3��T4ʱ��η�����Ӧ�Ļ�ѧ����ʽ________��
��8������ԭ��Ʒ�е�����������������______��������������1λС����
��9��n��ֵ��_____��
���𰸡�Cu Al��Fe ��Cu 4Al+3O2�T2Al2O3 O2 H2O NaCl�ȣ��������ɣ� Ϳ�͡��ƽ����ȣ��������ɣ� ����װ�������� ͨһ����̼ �ž���������ֹ��ը ��ɫ������ɫ ȱ��β������װ�� Fe2O3+3CO![]() 2Fe+3CO2 20.7% 3
2Fe+3CO2 20.7% 3
��������
��һ����1��ͼ1��Y�������Ľ�����Cu��������Ϊͭ����ã����ܺ����ᷴӦ��
��2���������ᷴӦ���������ᷴӦ�����ң�������������ã�Al��Cu��Fe���ֽ����Ļ����ǿ������˳��ΪAl��Fe��Cu��
��3������һ�ֻ��ý���������������ȴ�н�ǿ�Ŀ���ʴ�ԣ���ԭ����ͨ����������ܺ�������Ӧ��������������Ĥ����Ӧ�Ļ�ѧ����ʽΪ��4Al+3O2�T2Al2O3��
�����������������Ϊ����ˮ������ͬʱ�Ӵ���ʳ��ˮ�ɼ���������ʴ��Ϊ�˷�ֹ����Ʒ���⣬Ӧ��ȡ�Ĵ�ʩ��Ϳ�ᡢ��һ��������ƳɺϽ����
��4��ʵ��ǰӦ�ȼ��װ����������
��5��Ϊ�˱�֤ʵ�鰲ȫ��ʵ�鿪ʼʱӦ��ͨ��һ���һ����̼��Ŀ�����ų�װ���еĿ�������ֹ������ը��
��6��A����������һ����̼��Ӧ�������Ͷ�����̼���������Ǻ��ɫ������ɫ����װ������һ�����Բ��㣬û�д���β����һ����̼��ɢ����������Ⱦ����
��7��T3-T4ʱ��Σ�������������������һ����̼��Ӧ�������Ͷ�����̼��������Ӧ�Ļ�ѧ����ʽΪ��Fe2O3+3CO![]() 2Fe+3CO2��
2Fe+3CO2��
��8���ɱ������ݿ�֪����Ӧ����ˮ��������5.4g�����ɶ�����̼������13.2g��
������������Ϊx��
Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
160 132
x 13.2g
![]()
x=16g��
����������![]() =
=![]() ��n=3��
��n=3��
��9��ԭ��Ʒ�е����������������ǣ�![]() ��100%=20.7%��
��100%=20.7%��