题目内容
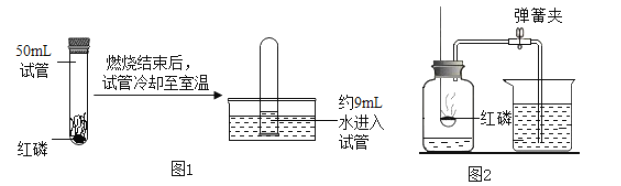
【题目】煤是社会生产、生活中最重要的能源,工业上常把煤进行气化和液化处理,使煤变成清洁能源。煤气化和液化流程示意图如下图所示,请结合图像回答问题:
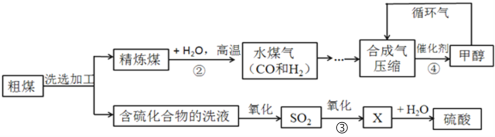
(1)精炼煤中主要成分是碳,步骤②中发生反应的化学方程式为__________。
(2)步骤③中,SO2进一步氧化得到X,X为硫的另一种氧化物,其中硫元素的化合价为+6价,X的化学式为________。
(3)经过进一步净化,含较多杂质的水煤气转化为合成气(CO和H2的混合气体),步骤④中生成的甲醇(CH3OH)是一种重要的化工原料,该反应的化学方程式为_________,该反应的基本类型是 _________。
(4)循环气的主要成分是__________和少量未完全分离出去的甲醇。
(5)从“绿色化学”的角度分析,“煤的气化和液化”流程的优点:_________。
【答案】C + H2O ![]() CO + H2 SO3 CO + 2H2
CO + H2 SO3 CO + 2H2 ![]() CH3OH 化合反应 CO、H2 原料全部转化为产品或实现“零排放”,不对环境造成污染 (从绿色化学角度) 。
CH3OH 化合反应 CO、H2 原料全部转化为产品或实现“零排放”,不对环境造成污染 (从绿色化学角度) 。
【解析】
(1)碳和水在高温的条件下反应生成一氧化碳和氢气,故反应的化学方程式写为:C + H2O ![]() CO + H2。
CO + H2。
(2)设这种硫的氧化物的化学式为SxOy,硫元素的化合价为+6价,氧元素的化合价为-2价,化合物在各元素的化合价的代数和为零,则x×(+6)+(-2)×y=2,x:y=1:3,所以该氧化物的化学式为SO3,故填SO3。
(3)该反应是一氧化碳和氢气在催化剂的条件下反应生成甲醇,故反应的化学方程式写为:. CO + 2H2 ![]() CH3OH;
CH3OH;
由化学方程式可知,该反应是两种物质反应生成一种物质,属于化合反应,故填化合反应。(4)由题干可知:循环气的主要成分与合成气的成分是相同的,为一氧化碳和氢气,故填CO、H2。
(5)由图可知,从“绿色化学”的角度分析,该流程的优点是原料全部转化为了产品,没有产生污染物,故填原料全部转化为产品或实现“零排放”,不对环境造成污染。

【题目】金属是现代生活和工业生产中应用极为普遍的一类材料。
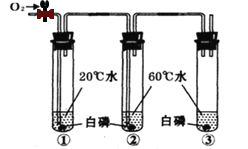
(一)已知在相同的条件下,金属的活动性越强,金属和酸反应产生气泡(氢气)的速度就越快。Al、Cu、Fe三种金属在稀盐酸里的反应现象如图1所示。

(1)图1中Y所代表的金属是_____(填“Cu”或“Fe”);
(2)Al、Cu、Fe三种金属的活动性由强到弱的顺序为_____;
(3)铝是一种活泼金属,但常温下铝却有较强的抗腐蚀性,其原因是_____;(用方程式表示化学原理)
(二)防止金属腐蚀,特别是钢铁的锈蚀是世界科学研究和技术领域中的重大问题。铁生锈的条件为铁与_____、_____ 同时接触,_____(举一例物质)可加速铁的锈蚀。为了防止铁制品生锈,应采取的措施是_____(写出一种)。
(查阅资料)铁锈成分复杂,化学式可简单表示为Fe2O3nH2O.浓硫酸可以吸水,碱石灰可以吸收水和二氧化碳。
(提出问题)铁锈(Fe2O3nH2O)中n的值等于多少呢?
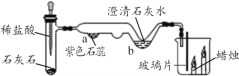
(问题探究)小明发现实验室中有一保管不善的铁粉,大部分已经结块成红褐色,为了探究铁锈(Fe2O3nH2O)的组成,称取27.0g这种铁粉样品,按如图2所示装置进行实验。
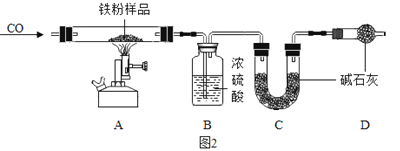
(4)实验前应先______。
(5)为了保证实验安全,实验开始时应先_____,目的是_____。
(6)A中的现象是_____,请指出该装置中有一处明显不足_____。
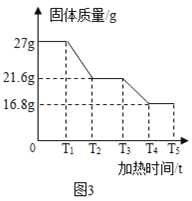
(数据处理)图3是加热时间和A中固体质量关系图象,下表是B、C中质量不再变化时B中浓硫酸、C中碱石灰装置质量变化情况。
反应前(g) | 反应后(g) | |
B | 100 | 105.4 |
C | 150 | 163.2 |
(7)写出T3﹣T4时间段发生反应的化学方程式________。
(8)计算原样品中单质铁的质量分数是______。(计算结果保留1位小数)
(9)n的值是_____。