题目内容
【题目】某兴趣小组的同学从实验收集到一桶含有FeSO4、CuSO4的废液, 他们想从中回收金属铜和硫酸亚铁晶体,设计了如下操作方案, 结合方案回答下列问题:
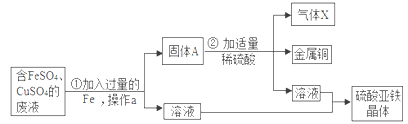
(1)固体A中含有_______(填化学式),无色气体X为_______(填化学式)。
(2)步骤①中反应的化学方程式为____________,该反应的基本类型为_________反应。
(3)操作a的名称为__________,在该操作中用到了玻璃棒其作用为_________。
(4)步骤②中加入适量稀硫酸的目的是_____________。
【答案】Fe和Cu H2 Fe+CuSO4==Cu+FeSO4 置换 过滤 引流 除去过量的铁粉
【解析】
(1)金属活动性中,排在前面的金属能将排在后面的金属从其化合物的水溶液中置换出来,铁位于铜的前面,因此铁能置换出硫酸铜溶液中的铜,Fe+CuSO4 ==Cu+FeSO4 ,A中含有剩余的铁以及生成的铜。Fe+ H2SO4 == FeSO4 + H2↑,所以X是H2。
(2)步骤①中反应的化学方程式为:Fe+CuSO4 ==Cu+FeSO4 ,由一种单质与一种化合物反应生成另一种单质与另一种化合物的反应是置换反应。
(3)通过过滤可将难溶于水的固体物质与液体分离,过滤操作中玻璃棒的作用是引流。
(4)此实验目的是回收金属铜和硫酸亚铁晶体,因此要将固体A中过量的铁除去,同时得到硫酸亚铁。

 暑假作业暑假快乐练西安出版社系列答案
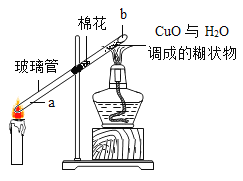
暑假作业暑假快乐练西安出版社系列答案【题目】小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
(提出猜想)除二氧化锰、氧化铜外,氧化铁也可以作氯酸钾分解的催化剂。
(完成实验)按下表进行实验:测定分解温度(分解温度越低,催化效果越好)。
实验编号 | 实验药品 | 分解温度 |
① | 氯酸钾 | 580℃ |
② | 氯酸钾、二氧化锰(质量比 1:1) | 350℃ |
③ | 氯酸钾、氧化铜(质量比 l:1) | 370℃ |
④ | 氯酸钾、氧化铁(质量比 1:1) | 390℃ |
(分析数据、得出结论)
(1)由实验_____对比,证明猜想合理;
(2)实验所用的三种金属氧化物,催化效果最好的是_____。
(3)若氧化铁是该反应的催化剂,请写出这个反应的化学方程式__________________。
(4)如表是二氧化锰用量与一定质量氯酸钾制取氧气反应速率关系的实验数据。
二氧化锰与氯酸钾的质量比 | 1/40 | 1/20 | 1/10 | 1/5 | 1/3 | 1/2 | 2/3 | 1/1 | 2/1 |
生成1L氧气所需时间(s0 | 124 | 79 | 50 | 54 | 75 | 93 | 106 | 153 | 240 |
①据如表可知二氧化锰与氯酸钾的质量比为_____时,反应速率最快;
②通过分析可知,在化学反应中催化剂的用量_____越多越好。(填“是”或“不是”)
③二氧化锰用量过多冲淡了氯酸钾粉末,相当于减少反应物的_________,所以反应速率受到影响。
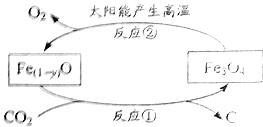
【题目】金属是现代生活和工业生产中应用极为普遍的一类材料。
(一)已知在相同的条件下,金属的活动性越强,金属和酸反应产生气泡(氢气)的速度就越快。Al、Cu、Fe三种金属在稀盐酸里的反应现象如图1所示。

(1)图1中Y所代表的金属是_____(填“Cu”或“Fe”);
(2)Al、Cu、Fe三种金属的活动性由强到弱的顺序为_____;
(3)铝是一种活泼金属,但常温下铝却有较强的抗腐蚀性,其原因是_____;(用方程式表示化学原理)
(二)防止金属腐蚀,特别是钢铁的锈蚀是世界科学研究和技术领域中的重大问题。铁生锈的条件为铁与_____、_____ 同时接触,_____(举一例物质)可加速铁的锈蚀。为了防止铁制品生锈,应采取的措施是_____(写出一种)。
(查阅资料)铁锈成分复杂,化学式可简单表示为Fe2O3nH2O.浓硫酸可以吸水,碱石灰可以吸收水和二氧化碳。
(提出问题)铁锈(Fe2O3nH2O)中n的值等于多少呢?
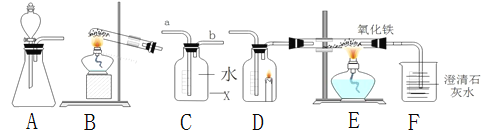
(问题探究)小明发现实验室中有一保管不善的铁粉,大部分已经结块成红褐色,为了探究铁锈(Fe2O3nH2O)的组成,称取27.0g这种铁粉样品,按如图2所示装置进行实验。

(4)实验前应先______。
(5)为了保证实验安全,实验开始时应先_____,目的是_____。
(6)A中的现象是_____,请指出该装置中有一处明显不足_____。
(数据处理)图3是加热时间和A中固体质量关系图象,下表是B、C中质量不再变化时B中浓硫酸、C中碱石灰装置质量变化情况。

反应前(g) | 反应后(g) | |
B | 100 | 105.4 |
C | 150 | 163.2 |
(7)写出T3﹣T4时间段发生反应的化学方程式________。
(8)计算原样品中单质铁的质量分数是______。(计算结果保留1位小数)
(9)n的值是_____。