题目内容
【题目】甲、乙、丙是初中化学常见三种物质,甲、乙、丙含有相同的一种元素,且丙是一种气体单质,它们相互转化关系如图.则甲的化学式为_________.甲转化为丙的文字表达式式为______其基本反应类型为_______.
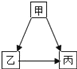
【答案】H2O2 过氧化氢![]() 氧气+水 分解反应.
氧气+水 分解反应.
【解析】
甲、乙、丙含有相同的一种元素,丙是一种气体单质,丙可能是氧气,甲能转化生成乙和丙,过氧化氢能够分解产生液体水和氧气,则甲可能是过氧化氢,乙可能是水,代入框图,猜想合理。
甲是过氧化氢,化学式为H2O2;甲转化为丙的反应是过氧化氢在二氧化锰催化作用下分解生成水和氧气,文字表达式为过氧化氢![]() 氧气+水;该反应是一种物质生成两种物质的反应,其基本反应类型为分解反应。
氧气+水;该反应是一种物质生成两种物质的反应,其基本反应类型为分解反应。

【题目】金属是现代生活和工业生产中应用极为普遍的一类材料。
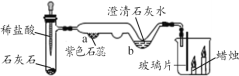
(一)已知在相同的条件下,金属的活动性越强,金属和酸反应产生气泡(氢气)的速度就越快。Al、Cu、Fe三种金属在稀盐酸里的反应现象如图1所示。

(1)图1中Y所代表的金属是_____(填“Cu”或“Fe”);
(2)Al、Cu、Fe三种金属的活动性由强到弱的顺序为_____;
(3)铝是一种活泼金属,但常温下铝却有较强的抗腐蚀性,其原因是_____;(用方程式表示化学原理)
(二)防止金属腐蚀,特别是钢铁的锈蚀是世界科学研究和技术领域中的重大问题。铁生锈的条件为铁与_____、_____ 同时接触,_____(举一例物质)可加速铁的锈蚀。为了防止铁制品生锈,应采取的措施是_____(写出一种)。
(查阅资料)铁锈成分复杂,化学式可简单表示为Fe2O3nH2O.浓硫酸可以吸水,碱石灰可以吸收水和二氧化碳。
(提出问题)铁锈(Fe2O3nH2O)中n的值等于多少呢?
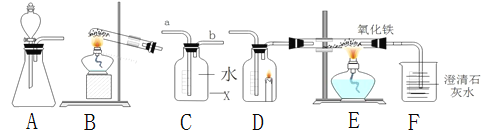
(问题探究)小明发现实验室中有一保管不善的铁粉,大部分已经结块成红褐色,为了探究铁锈(Fe2O3nH2O)的组成,称取27.0g这种铁粉样品,按如图2所示装置进行实验。

(4)实验前应先______。
(5)为了保证实验安全,实验开始时应先_____,目的是_____。
(6)A中的现象是_____,请指出该装置中有一处明显不足_____。
(数据处理)图3是加热时间和A中固体质量关系图象,下表是B、C中质量不再变化时B中浓硫酸、C中碱石灰装置质量变化情况。

反应前(g) | 反应后(g) | |
B | 100 | 105.4 |
C | 150 | 163.2 |
(7)写出T3﹣T4时间段发生反应的化学方程式________。
(8)计算原样品中单质铁的质量分数是______。(计算结果保留1位小数)
(9)n的值是_____。