题目内容
【题目】分析处理图表中的信息是学习化学的一种重要方法,如表是NH4Cl和KNO3在不同温度时的溶解度数据:
温度/℃ | 10 | 30 | 50 | 70 | |
溶解度/g | NH4Cl | 33.3 | 41.4 | 50.4 | 55.2 |
KNO3 | 20.9 | 45.8 | 85.5 | 110 | |
根据上述数据,回答下列问题:
(1)从上表可知,50℃时,NH4Cl的溶解度为g.
(2)NH4Cl和KNO3的溶解度受温度影响比较大的物质是(填化学式).
(3)欲配制质量分数为10%的KNO3溶液,需要的玻璃仪器有烧杯、量筒、胶头滴管和
(4)烧杯中A中是60℃时,含有100g水的NH4Cl不饱和溶液,经过如图1的变化过程(在整个过程中,不考虑水分的蒸发),则C烧杯中溶液的质量为g. 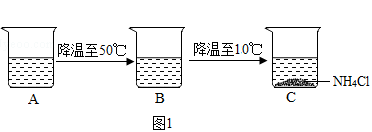
(5)某同学欲验证NH4Cl固体溶于水时吸收热量,设计如图2实验,通过观察到现象得以验证. 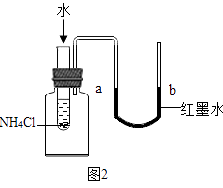
A.a端液面高于b端液面
B.a端液面低于b端液面.
【答案】
(1)50.4
(2)KNO3
(3)玻璃棒
(4)133.3
(5)A
【解析】解:(1)50℃时,NH4Cl的溶解度为50.4g;(2)根据表格可以看出,KNO3的溶解度受温度影响比较大;(3)由固体溶解配制溶液的一般步骤为:计算﹣称量﹣溶解;欲配制质量分数为10%的KNO3溶液,需要的玻璃仪器有烧杯、量筒、胶头滴管和玻璃棒;(4)由图可知,降温至10℃后,溶液中有晶体析出,说明达到了该温度下的饱和溶液,即:10℃时,100g水中最多溶解氯化铵33.3g,此刻饱和溶液的质量为:133.3g;(5)由图象可知,水中加入氯化铵后,U型管a侧液面上升,b侧液面下降,说明氯化铵溶于水温度降低,吸收热量; 答案:(1)50.4;(2)KNO3;(3)玻璃棒;(4)133.3g;(5)A.
【考点精析】认真审题,首先需要了解溶解时的吸热或放热现象(溶解时放热、吸热现象<溶解吸热:如NH4NO3溶解;溶解放热:如NaOH溶解、浓H2SO4溶解;解没有明显热现象:如NaCl>),还要掌握固体溶解度的影响因素(影响固体溶解度的因素:①溶质、溶剂的性质(种类) ②温度:大多数固体物的溶解度随温度升高而升高;如KNO3;少数固体物质的溶解度受温度的影响很小;如NaCl;极少数物质溶解度随温度升高而降低.如Ca(OH)2)的相关知识才是答题的关键.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案