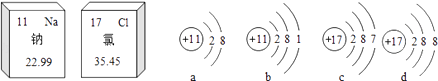题目内容
【题目】写出下列反应的化学方程式:
(1)铁在氧气中燃烧:;
(2)水通电分解:;
(3)用过氧化氢与二氧化锰制氧气;
(4)一氧化碳还原氧化铜:
【答案】
(1)3Fe+2O2 ![]() Fe3O4
Fe3O4
(2)2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
(3)2H2O2 ![]() 2H2O+O2↑
2H2O+O2↑
(4)CuO+CO ![]() Cu+CO2
Cu+CO2
【解析】解:(1)铁在氧气中燃烧的化学方程式为:3Fe+2O2 ![]() Fe3O4;(2)水通电分解的化学方程式为:2H2O
Fe3O4;(2)水通电分解的化学方程式为:2H2O ![]() 2H2↑+O2↑;(3)用过氧化氢与二氧化锰制氧气的化学方程式为:2H2O2
2H2↑+O2↑;(3)用过氧化氢与二氧化锰制氧气的化学方程式为:2H2O2 ![]() 2H2O+O2↑;(4)一氧化碳还原氧化铜的化学方程式为:CuO+CO
2H2O+O2↑;(4)一氧化碳还原氧化铜的化学方程式为:CuO+CO ![]() Cu+CO2 . 故填:3Fe+2O2
Cu+CO2 . 故填:3Fe+2O2 ![]() Fe3O4;2H2O
Fe3O4;2H2O ![]() 2H2↑+O2↑;2H2O2
2H2↑+O2↑;2H2O2 ![]() 2H2O+O2↑;CuO+CO
2H2O+O2↑;CuO+CO ![]() Cu+CO2 .
Cu+CO2 .
铁在氧气中燃烧生成四氧化三铁;
电解水生成氢气和氧气;
过氧化氢在二氧化锰催化作用下分解生成水和氧气;
高温条件下,氧化铜和一氧化碳反应生成铜和二氧化碳.

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案【题目】分析处理图表中的信息是学习化学的一种重要方法,如表是NH4Cl和KNO3在不同温度时的溶解度数据:
温度/℃ | 10 | 30 | 50 | 70 | |
溶解度/g | NH4Cl | 33.3 | 41.4 | 50.4 | 55.2 |
KNO3 | 20.9 | 45.8 | 85.5 | 110 | |
根据上述数据,回答下列问题:
(1)从上表可知,50℃时,NH4Cl的溶解度为g.
(2)NH4Cl和KNO3的溶解度受温度影响比较大的物质是(填化学式).
(3)欲配制质量分数为10%的KNO3溶液,需要的玻璃仪器有烧杯、量筒、胶头滴管和
(4)烧杯中A中是60℃时,含有100g水的NH4Cl不饱和溶液,经过如图1的变化过程(在整个过程中,不考虑水分的蒸发),则C烧杯中溶液的质量为g. 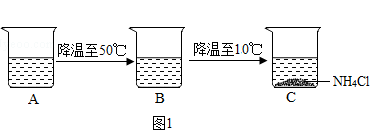
(5)某同学欲验证NH4Cl固体溶于水时吸收热量,设计如图2实验,通过观察到现象得以验证. 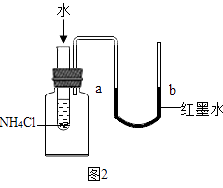
A.a端液面高于b端液面
B.a端液面低于b端液面.