题目内容
【题目】如下图是某校化学实验室从化学试剂商店买回的硫酸试剂瓶所贴标签上的部分内容,请你阅读后计算: 
(1)此瓶所盛液体(未开启前)的质量为g,其中溶质的质量为g.
(2)欲配制500g溶质的质量分数为19.6%的稀硫酸,需用这种硫酸mL.(结果保留一位小数)
(3)把(2)中配制成的稀硫酸全部用于和足量的锌反应,可制得氢气多少克?
【答案】
(1)920;901.6
(2)54.3
(3)解:由反应方程式:
Zn+ | H2SO4 | ═ | ZnSO4+ | H2↑ |
98 | 2 |
可知,98g硫酸与足量锌反应生成2g氢气.
【解析】解:(1)根据标签信息,溶液体积为500mL,密度为1.84g/mL,溶质的质量分数为98%, 溶液质量=500mL×1.84g/mL=920g,溶质质量=920g×98%=901.6g;(2)溶液稀释前后溶质质量不变,溶质的质量=500g×19.6%=98g,需要这种硫酸的体积=98g÷1.84g/mL÷98%≈54.3mL;
所以答案是:(1)920; 901.6;(2)54.3;(3)2g.
【考点精析】利用根据化学反应方程式的计算对题目进行判断即可得到答案,需要熟知各物质间质量比=系数×相对分子质量之比.

【题目】分析处理图表中的信息是学习化学的一种重要方法,如表是NH4Cl和KNO3在不同温度时的溶解度数据:
温度/℃ | 10 | 30 | 50 | 70 | |
溶解度/g | NH4Cl | 33.3 | 41.4 | 50.4 | 55.2 |
KNO3 | 20.9 | 45.8 | 85.5 | 110 | |
根据上述数据,回答下列问题:
(1)从上表可知,50℃时,NH4Cl的溶解度为g.
(2)NH4Cl和KNO3的溶解度受温度影响比较大的物质是(填化学式).
(3)欲配制质量分数为10%的KNO3溶液,需要的玻璃仪器有烧杯、量筒、胶头滴管和
(4)烧杯中A中是60℃时,含有100g水的NH4Cl不饱和溶液,经过如图1的变化过程(在整个过程中,不考虑水分的蒸发),则C烧杯中溶液的质量为g. 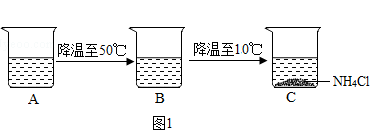
(5)某同学欲验证NH4Cl固体溶于水时吸收热量,设计如图2实验,通过观察到现象得以验证. 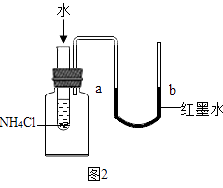
A.a端液面高于b端液面
B.a端液面低于b端液面.