题目内容
 氢氧化钠是一种重要的化工原料,某化学兴趣小组从它的结构、制备方法、性质以及变化规律等角度进行研究,请根据要求回答相应问题.
氢氧化钠是一种重要的化工原料,某化学兴趣小组从它的结构、制备方法、性质以及变化规律等角度进行研究,请根据要求回答相应问题.(1)结构:NaOH含有钠元素,钠在元素周期表中处于第三周期的
(2)制备:工业上可用从海水中制得的氯化钠制取烧碱,制取方法是:氯化钠溶液在通电条件下生成烧碱、氢气和氯气,试写出上述化学方程式:
(3)性质及变化:
①氢氧化钠固体暴露在空气中容易
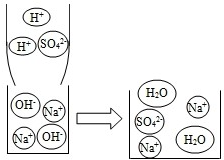
②如图所示,NaOH溶液可与稀酸反应的方程式为
a.镁条 b.酚酞 c.CuSO4 d.Ba(NO3)2
(4)保存:刘老师整理药品时,意外发现实验桌上有瓶敞口放置的NaOH固体,他让同学们对这瓶NaOH固体进行探究.
【提出猜想】
猜想Ⅰ:没有变质; 猜想Ⅱ:部分变质为Na2CO3; 猜想Ⅲ:全部变质
【实验设计、现象和推断】
| 实验步骤 | 实验现象 |
| ①取少量白色固体于试管中,加水振荡后,至全部溶解 | 无色溶液 |
| ②向试管的溶液中滴加适量物质X的溶液 | 现象A |
| ③再向试管中滴加几滴酚酞试液 | 现象B |
②若X是CaCl2溶液,则猜想Ⅱ成立的实验现象是
③定量研究:根据上述实验,可通过测定
考点:碱的化学性质,常见碱的特性和用途,盐的化学性质,书写化学方程式、文字表达式、电离方程式
专题:常见的碱 碱的通性
分析:(1)结构:根据元素周期表和碱的概念分析;
(2)制备:根据工业上氯化钠溶液制备烧碱的反应原理分析;
(3)性质及变化:
①根据氢氧化钠的性质分析;
②根据NaOH溶液与稀酸反应的原理分析;
根据各物质的性质分析;
(4)保存:【实验设计、现象和推断】
①根据钙离子和碳酸根离子会生成碳酸钙沉淀,酚酞遇到氢氧根离子会变成红色进行分析;
②滴加氯化钙溶液有白色沉淀产生,说明溶液中有碳酸钠,说明已变质;氯化钙、氯化钠溶液显中性,滴加酚酞溶液变成红色,说明溶液中有氢氧化钠;
③可通过测定产生气体的质量或产生白色沉淀的质量,再通过计算可得到氢氧化钠的变质情况.
(2)制备:根据工业上氯化钠溶液制备烧碱的反应原理分析;
(3)性质及变化:
①根据氢氧化钠的性质分析;
②根据NaOH溶液与稀酸反应的原理分析;
根据各物质的性质分析;
(4)保存:【实验设计、现象和推断】
①根据钙离子和碳酸根离子会生成碳酸钙沉淀,酚酞遇到氢氧根离子会变成红色进行分析;
②滴加氯化钙溶液有白色沉淀产生,说明溶液中有碳酸钠,说明已变质;氯化钙、氯化钠溶液显中性,滴加酚酞溶液变成红色,说明溶液中有氢氧化钠;
③可通过测定产生气体的质量或产生白色沉淀的质量,再通过计算可得到氢氧化钠的变质情况.
解答:解:(1)结构:
钠在元素周期表中处于第三周期的开头;
碱在溶液中都可以电离出相同的氢氧根离子;
(2)制备:
氯化钠溶液在通电条件下生成烧碱、氢气和氯气,反应的化学反应方程式为2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
(3)性质及变化:
①氢氧化钠固体曝露在空气中容易吸水潮解,因此能用作某些气体的干燥剂;
②NaOH溶液可与稀酸反应的方程式为2NaOH+H2SO4=Na2SO4+2H2O;该反应中反应前后大量减少的带正电的微观粒子是氢离子;
a、镁条可以和稀硫酸反应产生气体,因此加入镁条不产生气泡,则说明反应;
b、酚酞遇碱变红,因此滴加酚酞,若不变红,则说明反应;
c、硫酸铜能和氢氧化钠反应生成蓝色絮状沉淀,因此滴加硫酸铜溶液,若无蓝色絮状沉淀,则说明反应;
d、因硝酸钡和硫酸、硫酸钡反应都产生沉淀,因此无法用来判断是否反应;
故选d;
(4)保存:
①氢氧化钙和碳酸钠反应会生成碳酸钙沉淀和氢氧化钠,要检验氢氧化钠,就不能引入氢氧根离子;
②滴加氯化钙溶液有白色沉淀产生,说明溶液中有碳酸钠,说明已变质;氯化钙、氯化钠溶液显中性,滴加酚酞溶液变成红色,说明溶液中有氢氧化钠;
③可通过测定产生气体的质量或产生白色沉淀的质量,再通过计算可得到氢氧化钠的变质情况.
故答案为:(1)开头;OH-;
(2)2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
(3)①吸水潮解;②2NaOH+H2SO4=Na2SO4+2H2O;氢离子;d;
(4)①不能;
②现象A有白色沉淀产生,现象B溶液变成红色;
③产生气体的质量或产生白色沉淀的质量.
钠在元素周期表中处于第三周期的开头;
碱在溶液中都可以电离出相同的氢氧根离子;
(2)制备:
氯化钠溶液在通电条件下生成烧碱、氢气和氯气,反应的化学反应方程式为2NaCl+2H2O
| ||
(3)性质及变化:
①氢氧化钠固体曝露在空气中容易吸水潮解,因此能用作某些气体的干燥剂;
②NaOH溶液可与稀酸反应的方程式为2NaOH+H2SO4=Na2SO4+2H2O;该反应中反应前后大量减少的带正电的微观粒子是氢离子;
a、镁条可以和稀硫酸反应产生气体,因此加入镁条不产生气泡,则说明反应;
b、酚酞遇碱变红,因此滴加酚酞,若不变红,则说明反应;
c、硫酸铜能和氢氧化钠反应生成蓝色絮状沉淀,因此滴加硫酸铜溶液,若无蓝色絮状沉淀,则说明反应;
d、因硝酸钡和硫酸、硫酸钡反应都产生沉淀,因此无法用来判断是否反应;
故选d;
(4)保存:
①氢氧化钙和碳酸钠反应会生成碳酸钙沉淀和氢氧化钠,要检验氢氧化钠,就不能引入氢氧根离子;
②滴加氯化钙溶液有白色沉淀产生,说明溶液中有碳酸钠,说明已变质;氯化钙、氯化钠溶液显中性,滴加酚酞溶液变成红色,说明溶液中有氢氧化钠;
③可通过测定产生气体的质量或产生白色沉淀的质量,再通过计算可得到氢氧化钠的变质情况.
故答案为:(1)开头;OH-;
(2)2NaCl+2H2O
| ||
(3)①吸水潮解;②2NaOH+H2SO4=Na2SO4+2H2O;氢离子;d;
(4)①不能;
②现象A有白色沉淀产生,现象B溶液变成红色;
③产生气体的质量或产生白色沉淀的质量.
点评:本题考查了碱的性质和一些碱的特性,根据题中的问题结合学过的知识进行分析解答,难度不大.

练习册系列答案
 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
下列关于氧气的用途叙述不正确的是( )
| A、能助燃 |
| B、可以做火箭的燃料 |
| C、焊接或切割金属 |
| D、供病人呼吸 |