题目内容
有一种无色无味的液体A,在通电的条件下可以分解生成两种气体B和C,已知铁丝可以在B中剧烈燃烧,火星四射,生成一种黑色固体D;C在空气中燃烧发出淡蓝色火焰,并生成物质A.
(1)请写出A、B、C、D四种物质的化学式:A ;B ;C ;D .
(2)A通电分解时,在正极和负极产生的气体的体积比是 ;质量比是 .
(1)请写出A、B、C、D四种物质的化学式:A
(2)A通电分解时,在正极和负极产生的气体的体积比是
考点:物质的鉴别、推断,电解水实验,化学式的书写及意义
专题:常见物质的推断题
分析:(1)由题目的信息可知:一种无色无味的液体A,在通电的条件下可以分解生成两种气体B和C,水在通电的条件下生成氢气和氧气,铁丝可以在B中剧烈燃烧,火星四射,生成一种黑色固体D,铁和氧气在点燃的条件下生成四氧化三铁,因此A是水,B是氧气,C是氢气,D是四氧化三铁;
(2)根据电解水的知识进行分析,电解水时正极生成氢气,负极生成氧气,由反应的化学方程式可以求出生成的氧气和氢气的质量比进行解答.
(2)根据电解水的知识进行分析,电解水时正极生成氢气,负极生成氧气,由反应的化学方程式可以求出生成的氧气和氢气的质量比进行解答.
解答:解:(1)铁丝可以在B中剧烈燃烧,火星四射,生成一种黑色固体D,所以B是氧气,D是四氧化三铁,C是一种无色、无臭、难溶于水的气体,可以在空气中燃烧并产生淡蓝色火焰,C又是无色无味液体A在一定条件下生成的,所以C为氢气,无色无味液体A,在一定条件下可分解生成两种气体氢气和氧气,所以A为水,水在通电的条件下生成氢气和氧气,铁丝和氧气在点燃的条件下生成四氧化三铁,氢气和氧气在点燃的条件下生成水,推出的各种物质均满足题意,推导合理,所以A是H2O,B是O2,C是H2,D是Fe3O4;故答案为:H2O;O2;H2;Fe3O4;
(2)电解水时正极生成氢气,负极生成氧气,氧气和氢气的体积比是1:2,根据反应的化学方程式可以求出生成的氧气和氢气的质量比,
2H2O
2H2↑+O2↑
4 32
氧气和氢气的质量比为:32:4=8:1
故填:1:2;8:1.
(2)电解水时正极生成氢气,负极生成氧气,氧气和氢气的体积比是1:2,根据反应的化学方程式可以求出生成的氧气和氢气的质量比,
2H2O
| ||
4 32
氧气和氢气的质量比为:32:4=8:1
故填:1:2;8:1.
点评:在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.

练习册系列答案
相关题目
下列化学反应属于分解反应的是( )
A、硫+氧气
| ||||
B、蜡烛+氧气
| ||||
C、镁+氧气
| ||||
D、水
|
只用一种试剂一次就可将盐酸、氢氧化钠溶液、氯化钠溶液三种物质鉴别出来,这种试剂是( )
| A、紫色石蕊试液 |
| B、硫酸钠溶液 |
| C、二氧化碳 |
| D、硝酸银溶液 |
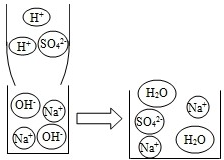 氢氧化钠是一种重要的化工原料,某化学兴趣小组从它的结构、制备方法、性质以及变化规律等角度进行研究,请根据要求回答相应问题.
氢氧化钠是一种重要的化工原料,某化学兴趣小组从它的结构、制备方法、性质以及变化规律等角度进行研究,请根据要求回答相应问题.
 !
!