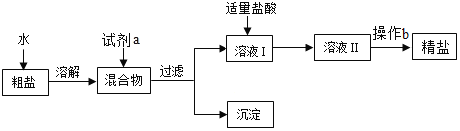
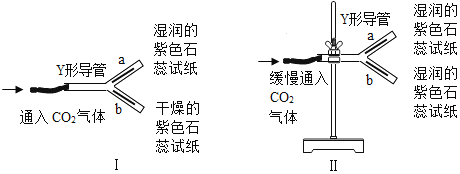
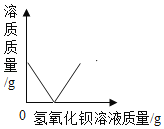
��Ŀ����
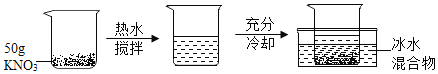
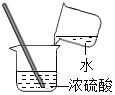
����Ŀ��С����ʵ�������������ʵ�飺������ȡ������������Ϊ30%���ܶ�Ϊ1.15gmL��1�Ľ�Ũ����40mL��46g����ˮ�������ϡ���ᣬ�ٸ�ʯ��ʯ��Ӧ�Ƶ����壬��������ͨ�����ʯ��ˮ����һֱδ�����dz��֡�Ϊ�ˣ�С�������ʦ����ʦ������ΪŪ��ԭ�����ʵ��̽������������̽���Ĺ��̣�����������������
��������⣩Ϊʲô�Ƶõ����岻��ʹʯ��ˮ����ǣ�
��������裩����һ������Ũ���Թ����������лӷ��������Ȼ�������
�����������ʯ��ˮ�Ѿ���ȫ����
��ʵ��̽����
ʵ����� | ʵ������ | ʵ����� |
������������ͨ��ϡ������������Ļ����Һ�� | ______ | ����һ��ȷ ��ѧ����ʽ______ |
����ȡ�������ó���ʯ��ˮ���Թ��У��μ�_____���� | ��Һ���ɫ | ���������ȷ |
���������ۣ�ԭ����������Ũ�ȴ�_____��Ӧ�������ٽ���ϡ�͡�
����˼��չ����С����ʵ��֤���˳���ʯ��ˮû����ȫ���ʣ����Dz�����˵������ʯ��ˮû�б��ʣ�������_____��
��������������̼�л��е������Ȼ������壬��ѡ�������Լ���_____������ĸ��ţ���
a����������Һ
bˮ
c���͵�̼��������Һ
d��������Һ
���𰸡�������ɫ���� HCl+AgNO3�THNO3+AgCl�� ��ɫ��̪��Һ 15% ʯ��ˮ���ֱ��ʣ�Ҳ��ʹ��̪��Һ���ɫ c
��������
[ʵ��̽��]����������ͨ��ϡ������������Ļ����Һ�У��Ȼ�������������������Һ��Ӧ�����Ȼ������������ᣬ����һ��ȷ����Ӧ�������Dz�����ɫ��������Ӧ�Ļ�ѧ����ʽΪ��HCl+AgNO3�THNO3+AgCl����
����������Һ�ʼ��ԣ���ʹ��ɫ��̪��Һ��죬��ȡ�������ó���ʯ��ˮ���Թ��У��μ���Һ���ɫ��˵���μӵ�����ɫ��̪��Һ��˵����������û����ȫ���ʣ�����������ȷ��
[��������]����ȡ������������Ϊ30%���ܶ�Ϊ1.15gmL��1�Ľ�Ũ����40mL��46g����ˮ�������ϡ���ᣬ��ԭ����������Ũ��Ϊ![]() ��100%��15%��
��100%��15%��
[��˼��չ]�ٲ��ֱ��ʺ��ʯ��ˮ���Ժ����������ƣ�Ҳ��ʹ��̪��Һ���ɫ��
��a ��CO2��HCl���������NaOH��Һ��Ӧ�������ܰ����ʳ�ȥ��Ҳ���ԭ���ʳ�ȥ�������ϳ���ԭ��ѡ�����
B��������̼���Ȼ������ˮ�������ܰ����ʳ�ȥ��Ҳ���ԭ���ʳ�ȥ�������ϳ���ԭ��ѡ�����
C���Ȼ����������뱥�͵�̼��������Һ��Ӧ�����Ȼ��ơ�ˮ�Ͷ�����̼���ܳ�ȥ������û�������µ����ʣ����ϳ���ԭ���ܳ�ȥ�Ȼ������壬���ܵõ�����Ķ�����̼��������Լ�����ѡ����ȷ��
D���Ȼ���������������Һ��Ӧ�����Ȼ������������ᣬ�ܳ�ȥ������û�������µ����ʣ����ϳ���ԭ��������̼������ˮ����������Լ���

����Ŀ��ʵ������ʧȥ��ǩ����ƿ��ɫ��Һ���ֱ�������������Һ��ϡ���ᡣΪ�˼�������������¼������Ȱ���ƿ��Һ�ֱ����ϱ�ǩA��B��Ȼ�����ʵ�顣
������Լ� | ʵ������ | ʵ����� | |
����1 | п�� | A������������ B�в������� | A��______��Һ�� B��______��Һ |
����2 | ̼������Һ | A��______�� B��______�� |
��ѧС��ͬѧ�Է���2��һ��̽�������������ʵ�鷽��
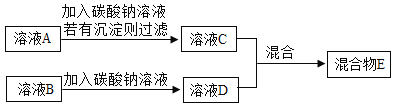
��ҺC����ҺD��ϣ��������������������
��1���������ݲ�����д����Ӧ�Ļ�ѧ����ʽ______��
��2�����г���������ͨ��������Ƴ���ҺC�е�������______��
��3�����������������E�����������������ʱ��д���������ʵĻ�ѧʽ______��