题目内容
【题目】(实验一)下图是实验室制取气体的一些装置,据图回答问题。
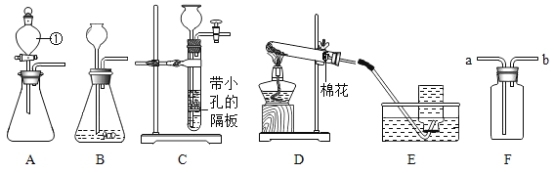
(1)写出制定仪器的名称①____
(2)实验室用C装置制取氢气,反应的化学方程式:_____,装置的优点:____.如果用装置F收集氢气,气体从____(填“a”或“b”)端管口通入。
(实验二)某化学兴趣小组对“酸和碱中和反应”进行探究,进行如下实验:取5ml氢氧化钠溶液于烧杯中,滴加酚酞试剂,溶液变红,接着滴加稀盐酸,用玻璃棒搅拌,溶液褪为无色,有关的化学方程式:_____
(1)(提出猜想)小明同学认为最终的溶液的溶质有二种可能:_____,②是氯化钠
(2)(设计实验)同学们设计了如下方案并进行实验:
实验操作 | 实验现象 | 实验结论 |
取少量溶液于试管中,向其中滴加_____ | ______ | 猜想①正确 |
【答案】分液漏斗 Zn+H2SO4=ZnSO4+H2↑ 控制反应的发生和停止 b HCl+NaOH=NaCl+H2O HCl和NaCl 紫色石蕊溶液 溶液变红
【解析】
(实验一)
(1)仪器①为分液漏斗;
(2)实验室用稀硫酸和锌粒反应制取氢气,化学方程式为:Zn+H2SO4=ZnSO4+H2↑。该装置有带孔隔板,可通过开关活塞使固液分离从而控制反应的发生和停止。若用装置F收集氢气,氢气密度小于空气,应从b端通入;
(实验二)
氢氧化钠溶液和稀盐酸反应化学方程式:HCl+NaOH=NaCl+H2O;
(1)最终的溶液有可能盐酸过量,溶质为HCl和NaCl;
(2)结合实验结论可知,需设计实验验证溶质中是否含有HCl。故可以取少量溶液于试管中,向其中滴加紫色石蕊试液,溶液变红,则含有HCl。

练习册系列答案
相关题目