题目内容
【题目】甲乙两种固体物质的溶解度曲线如图所示。
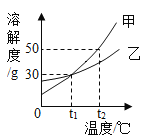
(1)![]() ℃时,若将75g甲的饱和溶液降温至
℃时,若将75g甲的饱和溶液降温至![]() ℃,析出甲的质量为________g;
℃,析出甲的质量为________g;
(2)![]() ℃时,将甲、乙两种物质的饱和溶液各100g降温至
℃时,将甲、乙两种物质的饱和溶液各100g降温至![]() ℃(其他条件不变)。所得溶液的溶质质量分数的关系是:甲____乙(填“>”、“=”或“<”)。
℃(其他条件不变)。所得溶液的溶质质量分数的关系是:甲____乙(填“>”、“=”或“<”)。
【答案】10 =
【解析】
(1)由图可知,![]() ℃时,甲的溶解度为50g,即100g水中溶解50g甲达到饱和,
℃时,甲的溶解度为50g,即100g水中溶解50g甲达到饱和,![]() ℃时,甲的溶解度为30g,即100g水中溶解30g甲达到饱和,
℃时,甲的溶解度为30g,即100g水中溶解30g甲达到饱和,![]() ℃时,75g甲的饱和溶液由50g水和25g甲组成,
℃时,75g甲的饱和溶液由50g水和25g甲组成,![]() ℃时,50g水中溶解15g甲达到饱和,若将
℃时,50g水中溶解15g甲达到饱和,若将![]() ℃时,75g甲的饱和溶液降温至
℃时,75g甲的饱和溶液降温至![]() ℃,析出晶体的质量为
℃,析出晶体的质量为![]() ;
;
(2)![]() ℃时,将甲、乙两种物质的饱和溶液降温至
℃时,将甲、乙两种物质的饱和溶液降温至![]() ℃(其他条件不变),仍然得到甲、乙的饱和溶液,由图可知此时甲、乙两种物质的溶解度相同,溶液溶质质量分数等于
℃(其他条件不变),仍然得到甲、乙的饱和溶液,由图可知此时甲、乙两种物质的溶解度相同,溶液溶质质量分数等于![]() ,二者的溶质质量分数相等,故填“=”。
,二者的溶质质量分数相等,故填“=”。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】石灰石样品的主要成分是碳酸钙(已知其它杂质不与盐酸反应)。某兴趣小组的同学将50g盐酸分5次加入到10g该石灰石样品中,得到如下部分数据和图象:
次数 | 第一次 | 第二次 | 第三次 |
加入盐酸的质量/g | 10 | 10 | 10 |
剩余固体的质量/g | 8 | 6 | 4 |
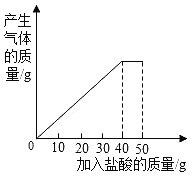
请计算:
(1)10g石灰石样品中所含杂质的质量为_______g.
(2)求所加盐酸的溶质质量分数._______
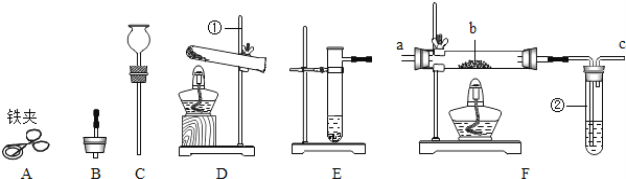
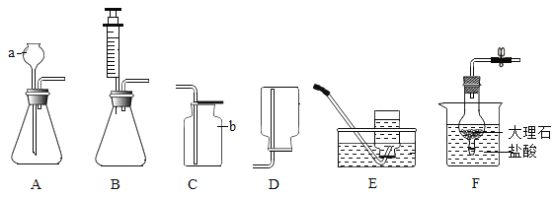
【题目】(实验一)下图是实验室制取气体的一些装置,据图回答问题。
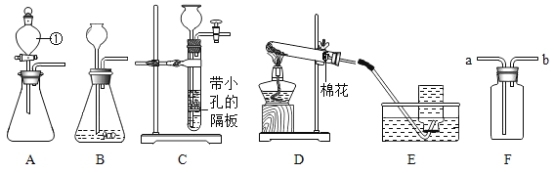
(1)写出制定仪器的名称①____
(2)实验室用C装置制取氢气,反应的化学方程式:_____,装置的优点:____.如果用装置F收集氢气,气体从____(填“a”或“b”)端管口通入。
(实验二)某化学兴趣小组对“酸和碱中和反应”进行探究,进行如下实验:取5ml氢氧化钠溶液于烧杯中,滴加酚酞试剂,溶液变红,接着滴加稀盐酸,用玻璃棒搅拌,溶液褪为无色,有关的化学方程式:_____
(1)(提出猜想)小明同学认为最终的溶液的溶质有二种可能:_____,②是氯化钠
(2)(设计实验)同学们设计了如下方案并进行实验:
实验操作 | 实验现象 | 实验结论 |
取少量溶液于试管中,向其中滴加_____ | ______ | 猜想①正确 |
【题目】根据下表回答问题。
温度(C) | 20 | 40 | 50 | 60 | 80 | |
溶解度(g) |
| 36.0 | 36.6 | 37.0 | 37.3 | 38.4 |
| 31.6 | 63.9 | 85.5 | 110 | 169 | |
(1)20℃时,![]() 溶解度是________________g;
溶解度是________________g;
(2)![]() 溶液可以用蒸发溶剂的方法提取溶质的理由是__________;
溶液可以用蒸发溶剂的方法提取溶质的理由是__________;
(3)在60℃时将120g ![]() 和34g
和34g ![]() 溶于100g水中,充分溶解后降温至20℃,过滤,理论上可得到晶体________________g。
溶于100g水中,充分溶解后降温至20℃,过滤,理论上可得到晶体________________g。
【题目】中国科学家屠呦呦因青蒿素和双氢青蒿素而荣获了诺贝尔奖。兴趣小组在老师的指导下对此进行了相关学习与探究。
(资料查阅)(1)青蒿素易溶于乙醚,在水中几乎不溶。
(2)双氢青蒿素是由碳、氢、氧元素组成的,且其相对分子质量不大于300。
(实验探究1)乙醚浸取法制青蒿素的主要工艺如下图所示:

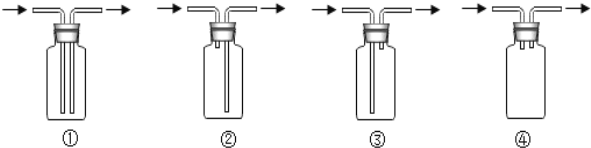
操作I需要的玻璃仪器主要有:烧杯、漏斗、__________,操作II的原理是利用物质__________的不同。
(实验探究2)小组同学设计如下图所示实验测定双氢青蒿素的组成,将7.1g的双氢青蒿素放在燃烧管C中燃烧,回答下列问题。

(1)装置B中试剂名称为__________,请将装置B中的导管补画完整___________。
(2)写出E中发生反应的化学方程式______________________。
(3)实验测得数据如表:
装置(包括药品)质量 | 实验前/g | 实验后/g |
D | 84.6 | 90.0 |
E | 90.2 | 106.7 |
根据所给数据计算出双氢青蒿素中的碳元素和氢元素的质量比为___________。
(4)写出双氢青蒿素充分燃烧的化学方程式:______________________。
(反思拓展)对“实验探究2”的分析,下列说法正确的是___________。
A 若缺少装置B,则测出的双氢青蒿素中氢元素的质量偏大
B 若缺少氧化铜,则测出的双氢青蒿素中碳、氧元素的质量比偏小
C 若缺少装置F,则测出的双氢青蒿素中碳元素质量偏小。