题目内容
【题目】根据下列图示(装置中的夹持和支撑部分省略)和相关叙述,回答下列问题:
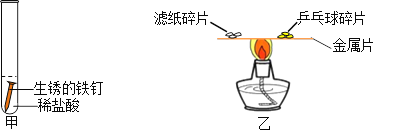
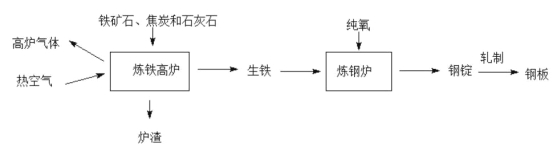
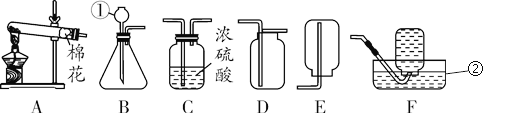
(1)铁锈是铁与__________________之间发生的复杂的化学反应。
(2)使试管甲中溶液变黄色的化学反应所属的化学反应基本类型是___________________。
(3)图乙是探究可燃物燃烧条件的操作。金属片选用____________(选填“铜片”或“铝片”或“铁片”)最好。
(4)实验时,金属片上最先燃烧起来的是______________碎片。
(5)根据图乙实验得出可燃物燃烧的条件之一是_______________________________________。
【答案】 氧气和水 复分解反应 铜片 乒乓球 温度达到可燃物的着火点
【解析】(1)铁锈是铁与氧气和水之间发生的复杂的化学反应;(2)使试管甲中溶液变黄色的化学反应是氧化铁和稀盐酸反应生成氯化铁和水,Fe2O3 + 6HCl ![]() 2 FeCl3 + 3H2O
2 FeCl3 + 3H2O
,属于复分解反应;(3)图乙是探究可燃物燃烧条件的操作。金属片选用铜片最好,因为铜的导热性更好;(4)乒乓球的着火电低于滤纸的着火点,实验时,金属片上最先燃烧起来的是乒乓球碎片;(5)根据图乙实验可知乒乓球燃烧,滤纸不燃烧,说明可燃物燃烧的条件之一是温度达到可燃物的着火点。

【题目】实验室有一瓶长期放置的氢氧化钠固体,某兴趣小组同学欲对该固体变质情况进行探究。
Ⅰ.固体的成分分析
【提出问题】该瓶氢氧化钠固体是否变质,变质情况如何?
【查阅资料】①氢氧化钠在空气中容易变质但不会转化为NaHCO3;
②CaCl2溶液的pH=7。
③碱石灰是CaO和NaOH的混合物
【提出猜想】猜想Ⅰ:固体未变质,只有NaOH
猜想Ⅱ:固体全部变质,只有Na2CO3
猜想Ⅲ:固体部分变质,是NaOH 和Na2CO3 的混合物
【原因分析】氢氧化钠在空气中变质的原因是_______________(用化学方程式表示)。
【进行实验】小聪同学取少量样品于烧杯中,用足量水溶解,再向溶液中滴入几滴酚酞试液,溶液变红,由此他得出猜想Ⅰ正确,但其他同学很快予以否定,否定的理由是________________,为了进一步得出结论,组内其他三位同学分别取小聪实验后的溶液于试管中,进行如下表所示实验。
同学 | 小钱 | 小徐 | 小陆 |
实验操作 | 加入适量氢氧化钙溶液 | 加入过量氯化钙溶液 | 逐滴加入稀盐酸至过量 |
【实验结论】小钱、小徐的实验中都观察到有白色沉淀生成且溶液仍是红色,于是他们都得出猜想Ⅲ正确。
【反思评价】(一)老师指出,仅凭小钱的实验操作和现象无法确定猜想Ⅲ正确,理由是__________________。
(二)根据小徐的结论推测小陆实验现象是_________________________________。
Ⅱ 固体中各成分含量
【提出问题】如何测定变质的氢氧化钠固体中碳酸钠的质量分数?
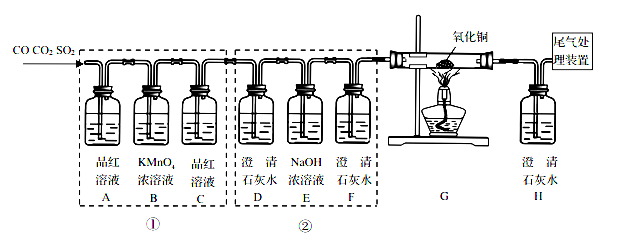
【进行实验】化学小组同学设计了如下实验装置。
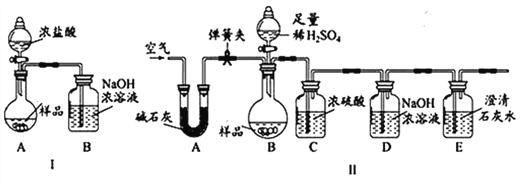
(一)小陆同学认为通过测定装置 I中反应前后B的质量差,再通过相应计算,就可测定Na2CO3的纯度,小组内同学通过讨论认为不可以,其理由可能是 _______________________;
(二)小钱同学在大家讨论的基础上,设计了装置II。请分析:装置II中A的作用_____________;若无装置C,对测定结果造成的影响是_____________(填“偏大”、“偏小”或“无影响”);E装置的作用是_______________________________。
【实验结论】称取10g样品于圆底烧瓶中,实验结束后,测得装置D增重2.2g,请你计算出样品中Na2CO3质量分数为____________。(写出计算过程)
【反思评价】(一)实验室中的氢氧化钠应密封保存,除了因为空气中有二氧化碳,还因为___________。
(二)若将上述5g氢氧化钠固体全部溶解在45g水中,得到的溶液中氢氧化钠质量分数______10%(填“大于”、“小于”或“等于”)。