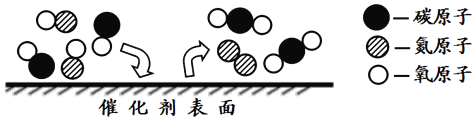
题目内容
【题目】(1)由下图可知C物质的溶解度随温度的升高而_____(填“增大”、“减小”或“不变”);

(2)在t2℃时,A、B、C三种物质的溶解度由大到小的顺序是_________;
(3)将t2℃时等质量的A、B、C三种物质的饱和溶液分别降温到t1℃,析出晶体最多的是_______;
(4)在t1℃时,将20 g A物质加入到盛有50 g水的烧杯中,充分搅拌,再升温至t2℃,所得溶液中溶质与溶剂的质量比是________。
【答案】 减小 A>B>C A 2:5
【解析】(1)通过分析溶解度曲线可知,C物质的溶解度随温度的升高而减小;(2)在t2℃时,A、B、C三种物质的溶解度从大到小的顺序是:A>B>C;(3) t1℃时,B物质的溶解度最大,A、C物质的溶解度相等,将t2℃时等质量的A、B、C三种物质的饱和溶液分别降温到t1℃,A、B物质会析出晶体,且A析出多于B,C物质不会析出晶体;(4) t1℃时,A物质的溶解度是20g,所以将20克A物质加入到50 g水,只能溶解10克,t2℃时A物质的溶解度是40g,50g水能溶解20克A,故所得溶液中溶质与溶剂的质量比=20:50= 2:5。

【题目】根据如表回答问题
温度(℃) | 20 | 40 | 50 | 60 | 80 | |
溶解度 (g/100g水) | NaCl | 36.0 | 36.6 | 37.0 | 37.3 | 38.4 |
NH4Cl | 37.2 | 45.8 | 50.4 | 55.2 | 65.6 | |
KNO3 | 31.6 | 63.9 | 85.5 | 110 | 169 | |
(1)50℃时,100g水中最多溶解NaCl______ g
(2)A是80℃含有120g水的KNO3溶液,经过如下操作,得到102gKNO3固体。

① A溶液为________(选填“饱和”或“不饱和”)溶液
② 对以下过程的分析,正确的是_________(选填编号)
a.A到B的过程中,溶质质量没有改变 b.B中溶质与溶剂的质量比为169:100
c.A溶液的质量等于222g d.开始析出KNO3固体的温度在60℃至80℃之间