题目内容
【题目】某研究小组对自动充气气球(示意图如下)进行下列探究。
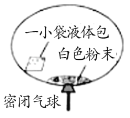
(查阅资料)该反应充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气。
(1)通常用澄清的石灰水来检验气体是二氧化碳,该反应的化学方程式 为_____。
(2)室温时,用pH试纸测得溶液的pH=3,该溶液呈_____性。
(3)探究白色粉末成分:
(猜想与假设)甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠。
(设计并进行实验)
实验一:完成下表:
操作步骤 | 现象 | 结论 |
_____ | _____ | 甲同学的猜想不正确 |
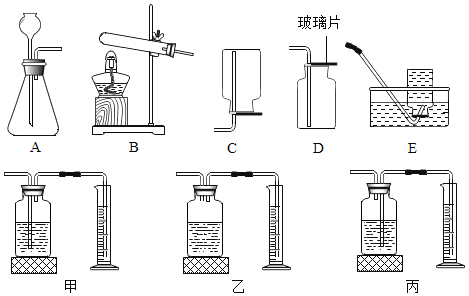
实验二:室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的稀盐酸,并测量生成二氧化碳的体积(装置如图),记录如下表:
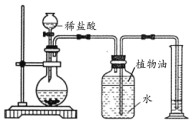
实验编号 | 锥形瓶内物质 | 最终得到CO2体积/mL | |
名称 | 质量/g | ||
① | 碳酸氢钠 | 0.8 | V1 |
② | 碳酸钠 | 0.8 | V2 |
③ | 白色粉末 | a | V1 |
(4)实验装置中植物油的作用是_____;表中a=_____;V1_____V2(填“﹥”、“﹤”或“=”)。
(分析并得出结论)
(5)分析上表中数据得出结论:白色粉末的成分是_____,依据是_____。
【答案】Ca(OH)2+CO2=CaCO3↓+H2O 酸 取少量白色粉末与试管中,加适量水 固体完全溶解 使二氧化碳与水隔绝 0.8 > NaHCO3 等质量白色粉末与NaHCO3生成气体的量相同
【解析】
(1)通常用澄清的石灰水来检验气体是二氧化碳,氢氧化钙和二氧化碳反应生成碳酸钙和水。
(2)pH小于7,显酸性。
(3)碳酸钙不溶于水,碳酸钠和碳酸氢钠易溶于水。
(4)二氧化碳能溶于水;对照实验只能有一个变量;等质量的碳酸氢钠、碳酸钠和足量的稀盐酸反应,碳酸氢钠产生二氧化碳更多。
(5)等质量白色粉末与NaHCO3生成气体的量相同。
(1)通常用澄清的石灰水来检验气体是二氧化碳,氢氧化钙和二氧化碳反应生成碳酸钙和水,该反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O。
(2)pH小于7,显酸性,室温时,用pH试纸测得溶液的pH=3,该溶液呈酸。
(3)探究白色粉末成分:
实验一:完成下表:碳酸钙不溶于水,碳酸钠和碳酸氢钠易溶于水。
取少量白色粉末与试管中,加适量水;固体完全溶解,甲同学的猜想不正确。
(4)二氧化碳能溶于水,实验装置中植物油的作用是使二氧化碳与水隔绝;对照实验只能有一个变量,表中a=0.8g;等质量的碳酸氢钠、碳酸钠和足量的稀盐酸反应,碳酸氢钠产生二氧化碳更多,V1 > V2。
(5)分析上表中数据得出结论:白色粉末的成分是NaHCO3 ;依据是等质量白色粉末与NaHCO3生成气体的量相同。