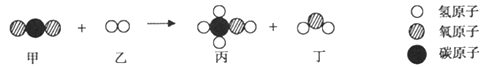
题目内容
【题目】某氢氧化钠样品中混有氯化钠,为测定样品中氢氧化钠的质量分数,称取5 g样品,加入27 g水完全溶解后,缓慢加入稀盐酸,同时测定溶液的pH。当pH=7时,刚好用去10%的稀盐酸36.5 g。计算:
(1)样品中氢氧化钠的质量分数。
(2)反应后所得溶液中溶质的质量分数。
【答案】80% @10%
【解析】设样品中氢氧化钠的质量为x,反应后生成氯化钠的质量为y
NaOH + HCl = NaCl+ H2O
40 36.5 58.5
x 36.5g![]() y
y
![]() =
=![]() =
=![]() 得x=4.0g,y=5.85g
得x=4.0g,y=5.85g
故样品中氢氧化钠的质量分数为![]() =80%;
=80%;
(2)原样品中氯化钠的质量为5g-4g=1g,反应后溶液中溶质的质量为1g+5.85g=6.85g
反应后溶液的总质量为5g+27g+36.5g=68.5g
反应后溶液中溶质的质量分数为![]() 10%
10%

练习册系列答案
相关题目
【题目】下列实验方法一定能达到实验目的的是
选项 | 实验目的 | 实验方法 |
A | 检验一瓶气体是否为 | 将燃着的木条伸入瓶中 |
B | 鉴别 | 分别点燃,在火焰上方罩一干冷烧杯 |
C | 鉴别石灰水和 | 加入适量的稀盐酸 |
D | 比较Zn、Cu、Ag的金属活动性 | 将Zn和Ag分别放入 |