题目内容
【题目】如图中 A、B、C、D、E、F 为初中化学常见的六种物质。B是一种不含铁元素的黑色粉末,C 是一种常见的液体,D 由两种元素组成,E 可用于灭火,F 可用于改良酸性土壤。(图中用“一”表示两种物质能发生反应,用“→”或“![]() ”表示两种物质间能单向或双向转化,部分反应物和生成物及反应条件已略去,图中部分反应需在溶液中进行,物质是溶液的只考虑溶质)。请回答:
”表示两种物质间能单向或双向转化,部分反应物和生成物及反应条件已略去,图中部分反应需在溶液中进行,物质是溶液的只考虑溶质)。请回答:

(1)写出下列物质的化学式: C._________ D._________ E._________ F._________
(2)A 和 B 反应的化学方程式为_____________________________。
(3)图中有两物质能发生反应,但并未用线连接起来,该反应的现象为________________。
【答案】![]()
![]()
![]()
![]()
![]() 黑色固体逐渐消失,溶液变成蓝色
黑色固体逐渐消失,溶液变成蓝色
【解析】
A、B、C、D、E、F 为初中化学常见的六种物质,E 可用于灭火,F 可用于改良酸性土壤,E、F可发生反应,则E为二氧化碳,F为氢氧化钙,C是一种常见液体,则C为水,B是一种不含铁元素的黑色粉末,可通过反应得到水,则B为氧化铜;A能与氧化铜反应,能与水相互转化,故A是氢气;D由两种元素组成并能制得氢气,则D为盐酸,带入验证,推理正确。
根据以上分析可知:
(1)C、D、E、F的化学式分别为:![]() 、
、![]() 、
、![]() 、
、![]() 。
。
(2)A 和 B 反应即氢气与氧化铜在加热条件下反应生成铜和水,反应的化学方程式为![]() 。
。
(3)图中有两物质能发生反应,但并未用线连接起来,是氧化铜与盐酸能反应,反应生成氯化铜和水,氯化铜溶液显蓝色,故该反应的现象为黑色固体逐渐消失,溶液变成蓝色。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案【题目】废铁屑主要成分是铁,还有少量铁锈(Fe2O3),硫酸亚铁的生产工艺如图所示。
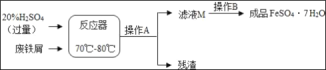
(1)在反应器中除发生Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,Fe2(SO4)3+Fe═3FeSO4这两个反应外,还会发生另外一个反应,化学方程式为:_____,反应器要加强通风,严禁烟火,其原因是:_____。
(2)将成品在有氧条件下焙烧,可转化为Fe2O3、SO2和SO3.为了提高SO3的产率,某实验小组进行了系列探究,实验数据如下:
编号 | 空气通入量/Ls﹣1 | 温度/℃ | SO2产率% | SO3产率/% |
a | 0.02 | 850 | 45.4 | 54.6 |
b | 0.06 | 850 | 30.5 | 69.5 |
c | 0.10 | 810 | 11.1 | 88.9 |
d | 0.10 | 850 | 11.1 | 88.9 |
e | 0.10 | 890 | 11.2 | 88.8 |
①本实验主要研究了哪些因素对SO3产率的影响_____。
②根据上表数据,生产过程中采用实验_____(填编号)的提取条件最合理。
③分析上表数据,空气的通入量对SO3的产率的影响规律是_____。
【题目】鸡蛋壳的主要成分是碳酸钙。为了测定某鸡蛋壳中碳酸钙的质量分数,小军同学进行了如下实验:
将鸡蛋壳洗净、干燥并捣碎后,与足量稀盐酸在烧杯中反应(假设鸡蛋壳中杂质不与稀盐酸反应)。
有关实验数据如表:
反应前 | 反应后 | ||
实验 数据 | 稀盐酸的质量 | 鸡蛋壳的质量 | 剩余物的质量 |
100g | 12g | 108.7g | |
(1)根据质量守恒定律可知,反应中产生二氧化碳气体______g。
(2)计算该鸡蛋壳中碳酸钙的质量_____。