题目内容
【题目】在一定条件下,NH3可以燃烧,且该反应能放出大量的热。下表是测定的部分数据
纯净物 | NH3 | O2 | H2O | X |
反应前质量/g | 1.7 | 3 | 0 | 0 |
反应后质量/g | 0 | 0.6 | 2.7 | 待测 |
根据数据可以判断下列选项正确的是: ( )
A. 反应后X的质量是2gB. X是由氮元素组成
C. X是由氮元素和氧元素组成D. X是由氮元素.氢元素.氧元素组成
【答案】B
【解析】
A、根据质量守恒定律,参加反应的各物质的质量总和等于反应后生成各物质的质量总和,则![]() ,则待测值为1.4g,则反应后X的质量是1.4g,故A不正确;
,则待测值为1.4g,则反应后X的质量是1.4g,故A不正确;
B、由表格中数据可知,反应前后氨气减少了1.7g,为反应物,氧气减少![]() ,为反应物,水增加了2.7g,为生成物,反应后X的质量是1.4g,则X是生成物,反应是氨气和氧气点燃生成和水和氮气,则X是由氮元素组成,故B正确;
,为反应物,水增加了2.7g,为生成物,反应后X的质量是1.4g,则X是生成物,反应是氨气和氧气点燃生成和水和氮气,则X是由氮元素组成,故B正确;
C、根据质量守恒定律,参加反应的各物质的质量总和等于反应后生成各物质的质量总和,则![]() ,则待测值为1.4g,则X是氮气,由氮元素组成,故C不正确;
,则待测值为1.4g,则X是氮气,由氮元素组成,故C不正确;
D、由C选项分析可知,X是氮气,由氮元素组成,故D不正确。故选B。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案【题目】2019年5月,187个国家签署了限制塑料废物交易协定,应对“白色污染”挑战。已知某种塑料的组成元素中有碳、氢两种元素,还可能有氧、氯元素中的一种或两种。为了测定其组成,某化学兴趣小组进行如下的探究。
(查阅资料)①无水氯化钙固体可做干燥剂;②有机物中的氯元素燃烧后通常转化为氯化氢。
(设计实验)兴趣小组设计并进行了如图所示的实验。(装置气密性良好)
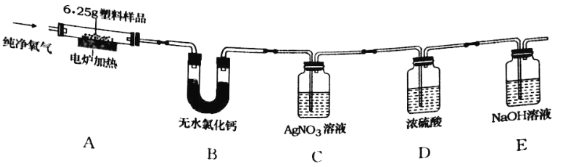
实验过程中,在装置C中观察到________现象,证明该塑料样品中含有氯元素,该反应的化学方程式是________。
(记录数据)6.25g样品在A装置中充分燃烧,反应产物被完全吸收后,测得相关实验数据如表。
装置 | B | C | D | E |
反应后装置增加的质量/g | 1.80 | 3.65 | 0.09 | 8.80 |
(分析与结论)根据以上数据分析与计算,6.25g样品中氢元素的质量为________g,该塑料样品的组成元素是________。
(反思评价)电炉加热前要先通一会儿氧气,目的是________。
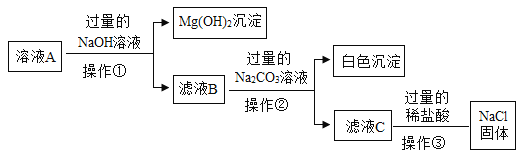
【题目】某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究。
(产品与原理)该厂采用“侯氏制碱法”生产化工产品——纯碱(Na2CO3)和化肥NH4Cl。
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应为:NaCl(饱和)+ NH3 + CO2 + H2O = NaHCO3↓+ NH4Cl;分离出NaHCO3晶体,加热制得纯碱。
(生产流程)

(相关资料)
(1) NH4Cl ![]() NH3↑+HCl↑
NH3↑+HCl↑
(2) 已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解的气体体积)
物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
(问题讨论):
(1)氨碱工业最关键的一步是:在加压的条件下不断向饱和的氨盐水中通入二氧化碳气体,溶液中会有碳酸氢钠晶体析出。试分析该流程需要加压条件的原因是:________。流程中加入过量氢氧化钠目的是________。操作II的名称叫________。
(2)反应①中发生了两个反应,写出其中的一个化学方程式:________________。
(3)反应③中得到纯碱的化学方程式为:_________________________________。
(4)上述生产流程中可循环使用的是________(填序号)。
A 气体C B 溶液D C 氢氧化镁 D 化肥NH4Cl
(5)在氨碱工业处理剩余的氯化铵溶液时。为何不直接蒸发结晶析出氯化铵固体?_________。
(组成确定)
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化。
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。由上述实验可确定纯碱样品含有杂质________(写化学式)。
(3)某研究性学习小组对刚生产出的纯碱产品进行检测。取22克该样品于烧杯中,加水将其溶解,然后逐滴加入溶质质量分数为14.6%的稀盐酸并不断振荡。
首先发生的反应是:Na2CO3+HCl=NaHCO3+NaCl;然后发生的反应是:NaHCO3+HCl= NaCl+H2O+CO2↑;
在上述过程中烧杯中溶液质量与加入稀盐酸质量的关系如图甲所示。

请你根据图甲提供的信息,计算出反应产生的二氧化碳的质量________;计算该样品中纯碱的质量分数________(计算结果用百分数表示,保留到小数点后一位)