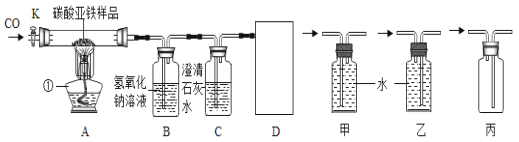
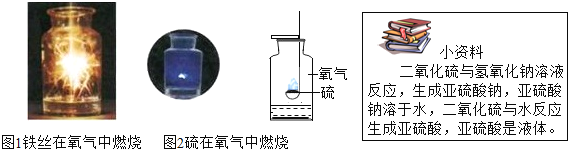
题目内容
【题目】实验室有碳酸钠和碳酸钙的固体混合物75g,使之与500g质量分数为14.6%的盐酸充分反应,将反应后的溶液蒸干得到82.7g固体。则原混合物中金属元素的质量分数为( )
A. 44%B. 46%C. 50%D. 55%
【答案】A
【解析】
碳酸钾和碳酸钙与稀盐酸反应后分别生成氯化钙和氯化钾,由方程式可知,碳酸钾和碳酸钙与稀盐酸反应后,可看成碳酸根离子被2个氯离子代替,两个氯离子的相对原子质量的和是71,碳酸根离子的相对原子质量是60,相差11,即完全反应后质量增加了11,份质量。实际反应后固体的质量增加了82.7g-75g=7.7g,设原混合物含碳酸根质量为x,则![]() 解得:x=42g;则所含金属元素的质量为75g-42g=33g,原混合物中金属元素的质量分数为
解得:x=42g;则所含金属元素的质量为75g-42g=33g,原混合物中金属元素的质量分数为![]() ×100%=44%,故选A。
×100%=44%,故选A。

 阅读快车系列答案
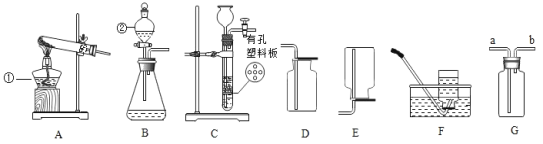
阅读快车系列答案【题目】小明、小芳二位同学为探究稀硫酸的化学性质,做了如下实验:
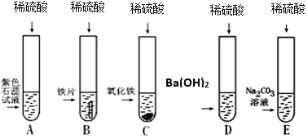
(1)试管A中的现象是____,反应后试管B中一定有的阳离子是____(写离子符号)。
(2)试管C中反应的化学方程式为_____。
(3)试管D中反应的化学方程式为____。
小芳同学把反应后D、E试管中的废液倒入一个洁净的烧杯中,过滤,得到白色沉淀和无色滤液,她决定对白色沉淀的成分进行探究。
(查阅资料)硫酸钡不溶于酸。
(作出猜想)I.BaSO4;II.BaCO3;III._____。
(拓展与反思)猜想II不成立,原因是_____。
(实验方案)
实验操作 | 实验现象与结论 |
过滤、洗涤白色沉淀备用;向白色沉淀中加入盐酸至过量 | ①若沉淀全部不溶解;猜想Ⅰ成立; ②若____,且有气泡产生,猜想III成立,其化学反应方程式为____。 |
【题目】在一定条件下,NH3可以燃烧,且该反应能放出大量的热。下表是测定的部分数据
纯净物 | NH3 | O2 | H2O | X |
反应前质量/g | 1.7 | 3 | 0 | 0 |
反应后质量/g | 0 | 0.6 | 2.7 | 待测 |
根据数据可以判断下列选项正确的是: ( )
A. 反应后X的质量是2gB. X是由氮元素组成
C. X是由氮元素和氧元素组成D. X是由氮元素.氢元素.氧元素组成