题目内容
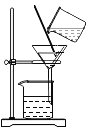
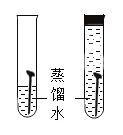
【题目】在一次实验课上,同学们用碳酸钠溶液鉴别氯化钙溶液和稀盐酸,实验结束后将试管中的物质倒入同一洁净的烧杯中,得到无色溶液(如图所示)。
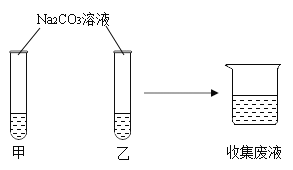
(1)如果试管甲中观察到有白色沉淀生成,则试管乙中发生反应的化学方程式为_______________。
(2)为处理实验废液,小组同学对废液成分进行探究:
[提出问题]假设二氧化碳全部逸出,废液中的溶质是什么?
[分析]小涛认为一定有氯化钠,其依据是_________________。
[猜想]可能有HCI、Na2CO3、CaCl2中的一种或两种。
[设计实验](本环节可供选择的试剂有稀HCI、Na2CO3溶液、CnCl2溶液、铁粉)
步骤 | 操作 | 现象 | 结论 |
① | 取烧杯中溶液样品,加入铁粉 | _________ | 溶液中含有HCl |
② | 取烧杯中溶液样品,滴加氯化钙溶液 | 无明显现象 | 溶液中不含Na2CO3 |
③ | __________________________ | _________________ | 溶液中含有CaCl2 |
[结论]废液中的溶质是HCI、NaCl、CaCl2。
[反思]小梅认为根据步骤①的现象,步骤②可以省略,原因是___________。
[应用]本实验废水直接排放,造成的影响是____________(写一种即可),若在不使用其他药品时,将实验后废液处理成中性后排放,在氢氧化钠、生石灰、石灰石三种物质中,应该选择______________。
【答案】Na2CO3+CaCl2=CaCO3↓+2NaCl 碳酸钠与氯化钙和盐酸均能反应生成氯化钠 产生气泡 取烧杯中溶液样品,滴加碳酸钠溶液 产生表示沉淀 碳酸钠能与盐酸反应,在同一溶液中不共存 腐蚀下水道或污染土壤 石灰石
【解析】
(1)碳酸钠能够与氯化钙反应生成碳酸钙沉淀和氯化钠,故试管乙中发生反应的化学方程式写为:Na2CO3+CaCl2=CaCO3↓+2NaCl。
(2){分析}碳酸钠与氯化钙和盐酸均能反应,且生成物中都有氯化钠,故填碳酸钠与氯化钙和盐酸均能反应生成氯化钠。
{实验设计}①由实验结论可知,溶液中含有盐酸,盐酸与铁反应生成氯化亚铁和氢气,观察到的现象是产生气泡,故填产生气泡;
③碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,所以可以向溶液中加入碳酸钠溶液来检验氯化钙是否存在,故填取烧杯中溶液样品,滴加碳酸钠溶液;
由实验结论可知,溶液中含有氯化钙,氯化钙会与加入的碳酸钠溶液反应生成碳酸钙沉淀,观察到的现象是产生白色沉淀,故填产生白色沉淀。
{反思}碳酸钠能与盐酸反应生成氯化钠、水和二氧化碳,步骤①证明溶液中含有盐酸,所以溶液中不可能含有碳酸钠,故填碳酸钠能与盐酸反应,在同一溶液中不共存。
{应用}由步骤①可知,废液中含有盐酸,如果实验废水直接排放,其中的盐酸会腐蚀下水道,还会污染土壤等,故填腐蚀下水道或污染土壤;
氢氧化钠与废液中的盐酸废液无明显的现象变化,不能判断盐酸是否除尽,选项错误;
氧化钙与盐酸废液也没有明显的现象变化,不能判断盐酸是否除尽,选项错误;
石灰石与盐酸反应生成二氧化碳产生气泡,现象明显,且石灰石不溶于水,即使石灰石过量,反应后过滤即可将其除去,选项正确,故填石灰石。