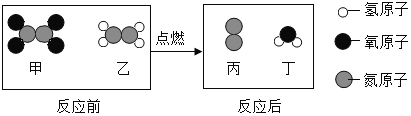
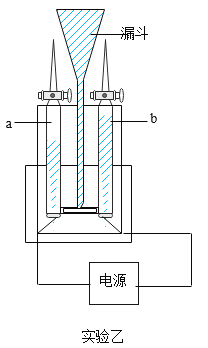
题目内容
【题目】请根据下图实验回答相关问题:
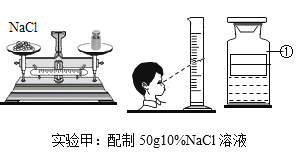
(1)实验甲中配好的溶液转移到仪器①中,仪器①的名称为________________。
(2)实验甲中称量氯化钠前天平需_________;若其他操作正确, 按图操作,所配制氯化钠溶液的溶质质量分数__________________(选填“大于”、“等于”或“小于”)10% ;根据实验目的,请在图中将标签上的内容填写完整____________。
(3)实验乙中反应的化学方程式为____________,实验过程中观察到漏斗中的液面上升,其原因是_____________。
【答案】细口瓶 调节平衡 小于 ![]() 2H2O
2H2O![]() 2H2↑+O2↑ 两侧玻璃管中生成气体产生较大的压强
2H2↑+O2↑ 两侧玻璃管中生成气体产生较大的压强
【解析】
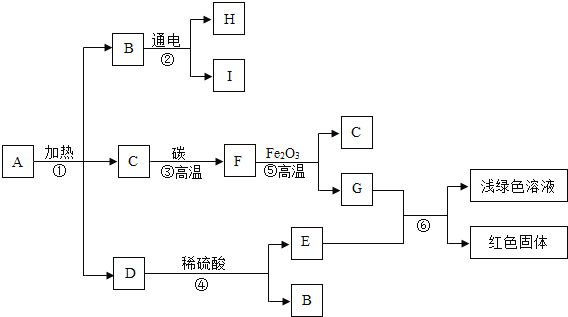
(1)由图可知,仪器①是盛放液体药品的细口瓶,故填细口瓶。
(2)使用托盘天平称量药品前,首先应将托盘天平调节平衡,故填调节平衡;
图中量取水时采用仰视的方式读取量筒内水的调节数,读数小于水的体积的实际值,则量取的水的体积偏大,则所配溶液的质量分数小于10%,故填小于;
书写盛放溶液的试剂瓶的标签时,标签的上方写溶质的化学式,下方写溶液的溶质质量分数,故该试剂瓶上的标签标为![]() 。
。
(2)由图可知,实验乙中的反应是水在通电的条件下反应生成氢气和氧气,故反应的化学方程式写为:2H2O![]() 2H2↑+O2↑;
2H2↑+O2↑;
实验过程中观察到漏斗中的液面上升是因为两侧玻璃管中生成气体产生较大的压强,使中间的玻璃管内的液面上升,故填两侧玻璃管中生成气体产生较大的压强。

【题目】黄铜是铜和锌的合金。某化学兴趣小组的同学欲测定实验室中某黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。称量10g粉末状黄铜样品放入烧杯中,量取45mL稀硫酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
第一次 | 第二次 | 第三次 | |
加入稀硫酸的体积(mL) | 15 | 15 | 15 |
生成氢气的质量(g) | m | 0.04 | 0.02 |
试求:
(1)m的数值_____。
(2)此黄铜样品中铜的质量分数是少?_____(写出计算过程)
【题目】在一次实验课上,同学们用碳酸钠溶液鉴别氯化钙溶液和稀盐酸,实验结束后将试管中的物质倒入同一洁净的烧杯中,得到无色溶液(如图所示)。
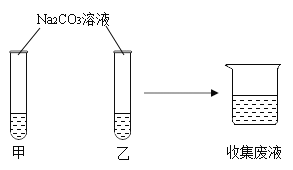
(1)如果试管甲中观察到有白色沉淀生成,则试管乙中发生反应的化学方程式为_______________。
(2)为处理实验废液,小组同学对废液成分进行探究:
[提出问题]假设二氧化碳全部逸出,废液中的溶质是什么?
[分析]小涛认为一定有氯化钠,其依据是_________________。
[猜想]可能有HCI、Na2CO3、CaCl2中的一种或两种。
[设计实验](本环节可供选择的试剂有稀HCI、Na2CO3溶液、CnCl2溶液、铁粉)
步骤 | 操作 | 现象 | 结论 |
① | 取烧杯中溶液样品,加入铁粉 | _________ | 溶液中含有HCl |
② | 取烧杯中溶液样品,滴加氯化钙溶液 | 无明显现象 | 溶液中不含Na2CO3 |
③ | __________________________ | _________________ | 溶液中含有CaCl2 |
[结论]废液中的溶质是HCI、NaCl、CaCl2。
[反思]小梅认为根据步骤①的现象,步骤②可以省略,原因是___________。
[应用]本实验废水直接排放,造成的影响是____________(写一种即可),若在不使用其他药品时,将实验后废液处理成中性后排放,在氢氧化钠、生石灰、石灰石三种物质中,应该选择______________。