题目内容
【题目】实验小组以粗盐(杂质为CaCl2、MgSO4和泥沙)为原料制取精盐(纯氯化钠晶体)。
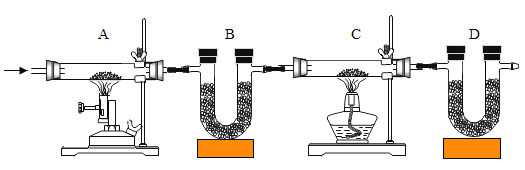
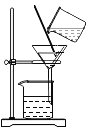
(1)第一步:取一定量的粗盐,加水溶解后,采用如图所示方法除去泥沙。然而小组成员发现,承接滤液的烧杯中,液体仍旧浑浊,请你帮他们分析造成这种情况的原因是什么? ___(说出一种即可)。
(2)第二步:为了除去食盐水中含有的CaCl2和MgSO4两种可溶性杂质,并获得纯净的氯化钠晶体,可选用的实验操作有:①加过量Na2CO3溶液;②加过量Ba(OH)2溶液;③加适量盐酸;④过滤;⑤蒸发结晶。请你将能达到目的的步骤顺序用序号标出_____________(不重复步骤)。[提示:Mg( OH)2、BaSO4、BaCO3、CaCO3难溶于水]
(3)小组成员猜测过滤后加盐酸前的滤液成分,认为其中一定含有两种杂质,请你设计合理的实验方案,通过实验步骤与现象验证他们的猜测。(提示:碳酸钠溶液呈碱性) ___。
【答案】滤纸破了;液面高于滤纸边缘;加水溶解的粗盐过于浑浊;承接滤液的烧杯本来就是脏的(答出一点即可) ②①④③⑤ 取少量滤液,向其中加入足量的BaCl2 溶液,有白色沉淀生成,则溶质中含有Na2CO3;静置,向上层清液中滴加无色酚酞溶液,溶液变红色,则溶质中还含有NaOH
【解析】
(1)过滤后,液体仍然浑浊的原因有:滤纸破了;液面高于滤纸边缘;承接滤液的烧杯本来就是脏的等。
(2)加入氢氧化钡溶液的目的是除去硫酸镁,加入碳酸钠溶液的目的是除去原有的氯化钙和过量的氢氧化钡,因此,加入氢氧化钡溶液必须在加入碳酸钠溶液之前;因为生成的沉淀中,碳酸钡、碳酸钙、氢氧化镁都能和稀盐酸反应,生成可溶于水的杂质,因此,加稀盐酸之前,必须过滤;最后蒸发结晶,可以得到氯化钠晶体。故操作步骤为②①④③⑤。
(3)因为第二步中加入的碳酸钠溶液和氢氧化钡溶液都是过量的,结合上述分析可知,过滤后加盐酸前的滤液中一定含有的杂质是碳酸钠和氢氧化钠,可通过以下实验进行验证:取少量滤液,向其中加入足量的BaCl2溶液,有白色沉淀生成,则溶质中含有Na2CO3;静置,向上层清液中滴加无色酚酞溶液,溶液变红色,则溶质中还含有NaOH。

 名校课堂系列答案
名校课堂系列答案【题目】在一次实验课上,同学们用碳酸钠溶液鉴别氯化钙溶液和稀盐酸,实验结束后将试管中的物质倒入同一洁净的烧杯中,得到无色溶液(如图所示)。
(1)如果试管甲中观察到有白色沉淀生成,则试管乙中发生反应的化学方程式为_______________。
(2)为处理实验废液,小组同学对废液成分进行探究:
[提出问题]假设二氧化碳全部逸出,废液中的溶质是什么?
[分析]小涛认为一定有氯化钠,其依据是_________________。
[猜想]可能有HCI、Na2CO3、CaCl2中的一种或两种。
[设计实验](本环节可供选择的试剂有稀HCI、Na2CO3溶液、CnCl2溶液、铁粉)
步骤 | 操作 | 现象 | 结论 |
① | 取烧杯中溶液样品,加入铁粉 | _________ | 溶液中含有HCl |
② | 取烧杯中溶液样品,滴加氯化钙溶液 | 无明显现象 | 溶液中不含Na2CO3 |
③ | __________________________ | _________________ | 溶液中含有CaCl2 |
[结论]废液中的溶质是HCI、NaCl、CaCl2。
[反思]小梅认为根据步骤①的现象,步骤②可以省略,原因是___________。
[应用]本实验废水直接排放,造成的影响是____________(写一种即可),若在不使用其他药品时,将实验后废液处理成中性后排放,在氢氧化钠、生石灰、石灰石三种物质中,应该选择______________。