题目内容
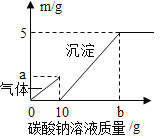
【题目】如图是a、b、c三种物质的溶解度曲线,下列说法错误的是
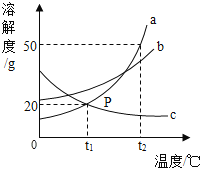
A.常温下,b物质易溶
B.t2℃时,a、b、c三种物质饱和溶液的溶质质量分数大小关系是a>b>c
C.将c的饱和溶液变为不饱和溶液,可采用降温的方法
D.t2℃时,60g a物质溶解于100g 水中,形成溶液质量为160g
【答案】D
【解析】
A、由图可知,常温下,b的溶解度一定大于20g,常温下的b溶解度大于10g,故常温下,b物质易溶,不符合题意;
B、由图可知,t2℃时,溶解度:a>b>c,故t2℃时,a、b、c三种物质饱和溶液的溶质质量分数大小关系是a>b>c,不符合题意;
C、由图可知,c的溶解度随温度的升高而减小,故将c的饱和溶液变为不饱和溶液,可采用降温的方法,不符合题意;
D、由图可知,t2℃时,a的溶解度为50g,即该温度下,100g水中最多能溶解50ga物质,故t2℃时,60g a物质溶解于100g 水中,形成溶液质量为150g,符合题意。
故选D。

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
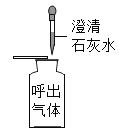
小学期末冲刺100分系列答案【题目】向一定量的NaOH溶液中慢慢通入CO2气体,看不到明显现象。某实验小组的同学对所得溶液成分进行了如下探究。请你参与他们的探究活动,并完成以下问题:
(提出问题)所得溶液中溶质的成分是什么?
(査阅资料)资料一:将CO2气体慢慢地通入一定量的NaOH溶液中,可能发生以下两个化学反应:
先发生反应:2NaOH+CO2═Na2CO3+H2O
当NaOH反应完全后,继续发生反应:Na2CO3+CO2+H2O═2NaHCO3
資料二;Ca(HCO3)2易溶于水;CaCl2溶液与NaCl溶液均呈中性; NaHCO3溶液呈碱性,可使酚酞溶液变红色。
(猜想与假设)小组同学通过讨论,提出了以下四种猜想
猜想一:溶质为NaOH和Na2CO3
猜想二:溶质全为Na2CO3
(1)你认为猜想三:溶质为_____
猜想四:溶质全为 NaHCO3
(实验探究)小组同学设计并完成了如下实验:
实验步骤 | 实验过程 | 实验现象 | 实验结论 |
① | 取适量反应后的溶液置于试管 中,加入过量CaCl2溶液 | 有白色沉淀生成 | (2)猜想_____不成立 |
② | 取适量步骤①反应后的上层清 液,滴加几滴酚酞溶液 | (3)现象为_____ | 猜想二不成立 |
③ | 取适量步骤①反应后的上层清 液,加入适量稀HCl | 有气泡产生 | (4)猜想_____成立 |
(实验总结)针对上述实验,实验小组的同学总结并写出了上述探究过程中的各步反应方程式。
(5)你认为步骤①发生反应的化学方程式是_____。