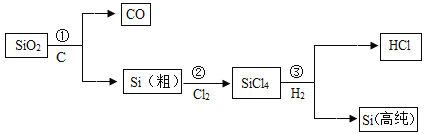
题目内容
【题目】某同学对实验室用石灰石和稀盐酸制取二氧化碳后的废液进行溶质成分鉴定,取废液上层清液50克,逐滴加入质量分数为26.5%的碳酸钠溶液,先出现气泡,后出现白色沉淀,继续滴加至沉淀不再产生。并把这过程绘制了如下图像。
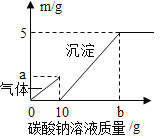
(1)废液中含有的溶质是_____(写化学式)。
(2)通过计算求a点的数值(写出计算过程)。
(3)碳酸钠溶液加至b点时,所得溶液的溶质质量分数是_____(精确到0.1%)。
【答案】(1)CaCl2 HCl;
(2)1.1g(详见解析)
(3)11.9%
【解析】
(1)向石灰石和稀盐酸制取二氧化碳后的废液,加入碳酸钠溶液,先出现气泡,说明有稀盐酸的存在,出现白色沉淀说明其中含有Ca2+,因此废液中含有的溶质是CaCl2 HCl。
(2)图中a点表示生成气体的最大值。可利用二氧化碳与碳酸钠在反应中的质量关系进行求解。
与盐酸反应的碳酸钠的质量=10g×26.5%=2.65g。
设生成二氧化碳气体的质量为x,生成的氯化钠的质量为y。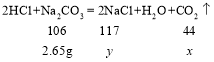
![]()
x=1.1g
所以a点的数值为1.1g;
![]()
y=2.925g
(3)设产生5g沉淀时消耗碳酸钠的质量为z,生成氯化钠的质量为m。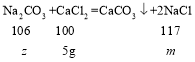
![]()
z=5.3g
![]()
m=5.85g;
含有5.3g碳酸钠的碳酸钠溶液质量=![]()
图像横坐标中的b点表示的溶液的质量=10g+20g=30g,
所以所得溶液的质量分数是:![]() 。
。

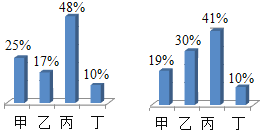
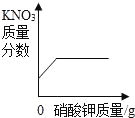
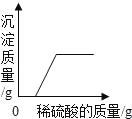
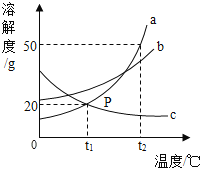
【题目】下列图象与所述实验相符的是( )
A | B | C | D |
向一定量锌粒中加入过量稀硫酸 | 向一定量氯化铵饱和溶液中不断加入水 | t℃时,向一定量不饱和的硝酸钾溶液中不断加入硝酸钾晶体 | 向一定量氢氧化钠和氢氧化钡的混合溶液中加入稀硫酸 |
|
|
|
|
A. AB. BC. CD. D
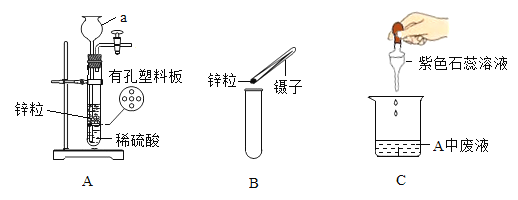
【题目】在20℃环境中,制取干燥的二氧化碳气体,并验证二氧化碳气体与氢氧化钠溶液可以发生化学反应,设计如图探究实验。
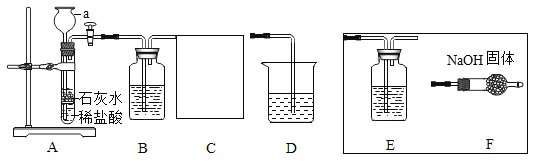
(查阅资料)
(1)碳酸钠、水、二氧化碳可以化合生成碳酸氢钠。
(2)20℃,氢氧化钠、碳酸钠和碳酸氢钠的溶解度如下表所示:
物质 | 氢氧化钠 | 碳酸钠 | 碳酸氢钠 |
溶解度/g | 110 | 21.8 | 9.6 |
(定性探究)
(1)装置F中导管外的玻璃仪器名称是_____。
(2)装置B中盛有碳酸氢钠溶液,目的是吸收装置A中挥发出的氯化氢气体,写出B中发生反应的化学方程式:_____。
(3)装置C的作用是_____,选择_____(选填E、F)装置达到实验目的。
(4)在实验过程中装置D中观察到_____,说明二氧化碳和氢氧化钠溶液能发生化学反应。