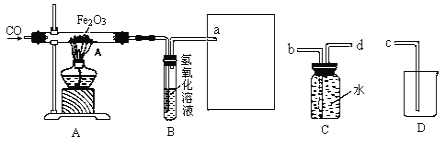
题目内容
【题目】某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图
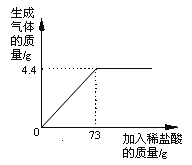
(1)纯碱恰好完全反应时,生成CO2的质量为 g
(2)计算该样品中含杂质的质量分数是多少?(计算结果保留一位小数,下同)
(3)计算当盐酸与纯碱恰好完全反应时,所得溶液的溶质质量分数是多少?
【答案】(1)4.4g(2)11.7% (3)16.3%
【解析】
试题分析:(1)纯碱样品中的主要成分为碳酸钠,可与盐酸反应生成二氧化碳气体。根据图示可知:当加入73g稀盐酸时,生成气体的质量达到了最大值,即此时碳酸钠恰好完全反应。所以恰好完全反应时生成二氧化碳的质量为4.4g。
(2)根据题意可知:已知量为二氧化碳的质量,未知量为样品中含杂质的质量分数。解题思路为:可根据反应中二氧化碳与碳酸钠的质量关系求出碳酸钠的质量。进一步可求出样品中含氯化钠的质量分数。
(3)根据题意可知:已知量为二氧化碳的质量,未知量为所得溶液中溶质的质量分数。解题思路为:所得溶液为氯化钠溶液,可根据反应中二氧化碳与氯化钠的质量关系求出生成氯化钠的质量。再加上样品中原有氯化钠的质量,即为所得溶液中的溶质的质量。再根据质量守恒定律可求出所得溶液的质量。最后可计算出所得溶液中溶质的质量分数。具体过程如下:
(2)解:设样品中含碳酸钠的质量为x,反应生成氯化钠的质量为y
Na2CO3+2HCl==2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
106:44=x:4.4g
x=10.6g
117:44=y:4.4g
y=11.7g
样品中含杂质的质量分数为:![]() ×100%≈11.7%
×100%≈11.7%
(3)所得溶液中溶质的质量分数为:![]() ×100%≈16.3%
×100%≈16.3%
答:(1)生成二氧化碳的质量为4.4g;
(2)样品中含杂质的质量分数为11.7%;
(3)所得溶液中溶质的质量分数为16.3%。

【题目】(8分)小明家有包开启了的小苏打,久置在灶台上方,可能因受热而变质。小明为此开展了探究,请分析其过程完成填空。
【查阅资料】
① 2NaHCO3![]() Na2CO3 + CO2 ↑ + H2O
Na2CO3 + CO2 ↑ + H2O
② NaHCO3 + NaOH = Na2CO3 + H2O
③ 2NaHCO3 + Ca(OH)2 = CaCO3 ↓ + Na2CO3 + 2H2O
④ Ca(HCO3)2 + Na2CO3 = CaCO3 ↓ + 2 NaHCO3
⑤ Na2CO3受热不分解,NaHCO3、Ca(HCO3)2都能溶与水。
【假设猜想】
假设一:小苏打没有变质,化学成分为 NaHCO3;
假设二:小苏打完全变质,化学成分为 ;
假设三:小苏打部分变质,化学成分为 。
【实验方案】
可选药品:①Ca(OH)2溶液 ②CaCl2溶液 ③NaOH溶液 ④稀盐酸
实验操作 | 实验现象 | 实验结论 |
操作一:取小苏打样品少量溶于足 量水后,加入过量的 (填药品编 号,下同),观察,如有沉淀,则继续进行下一步操作。 操作二:待操作一中反应充分后过 滤,并在滤液中加入过量的 ,观察。 | 操作一中无沉淀出现 | 假设一成立 |
假设二成立 | ||
假设三成立 |
【问题讨论】
有同学认为,取一定量样品直接加热,再将产生的气体通入澄清石灰水,根据实验现象,对上述三种假设的每一种是否成立都能进行判断。请评价这种方案是否合理 (填“是”或“否”),理由是 。