题目内容
【题目】某纯碱样品由碳酸钠和氯化钠两种物质组成。化学小组为测定该样品中碳酸钠含量,查阅资料,设计如图所示实验。(实验开始时装置气密性良好)
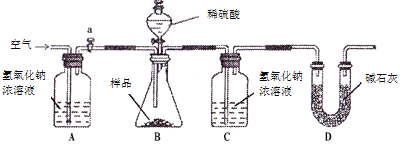
(1)写出A装置的作用及反应的化学方程式_____。
(2)若将B装置中的稀硫酸换成稀盐酸,对实验结果有何影响,说明理由。_____
(3)为达到实验目的,需测量的数据有哪些?_____
(4)利用上述装置测定样品中碳酸钠含量,简述实验步骤。_____
【答案】吸收空气的中二氧化碳;2NaOH+CO2===Na2CO3+H2O 盐酸具有挥发性,挥发出的氯化氢气体一同被氢氧化钠吸收,测定的Na2CO3含量会偏高 C装置反应前后的质量差 ①开始实验前先通一段时间空气,排出装置内的二氧化碳;②称量反应前装置C的质量;③关闭活塞a,同时打开分液漏斗的活塞,开始反应生成二氧化碳气体;④反应结束后,打开活塞a,继续通空气一段时间后,称量装置C的质量。⑤通过装置C的质量差计算样品中碳酸钠的含量。
【解析】
(1)A装置的作用是吸收空气中的二氧化碳,防止空气中二氧化碳对实验造成干扰;反应的化学方程式2NaOH+CO2===Na2CO3+H2O。
(2)如果将分液漏斗中的稀硫酸换成稀盐酸,盐酸具有挥发性,挥发出的氯化氢气体一同被氢氧化钠吸收,测定的Na2CO3含量会偏高;
(3)为达到实验目的,需测量的数据是反应前后C装置的质量,C装置反应前后的质量差即为反应生成二氧化碳的质量,根据二氧化碳的质量和反应的化学方程式可以计算碳酸钠的质量.
(4)①开始实验前先通一段时间空气,排出装置内的二氧化碳;
②称量反应前装置C的质量;
③关闭活塞a,同时打开分液漏斗的活塞,开始反应生成二氧化碳气体;
④反应结束后,打开活塞a继续通空气一段时间后,称量装置C的质量。
⑤通过装置C的质量差计算样品中碳酸钠的含量。

【题目】利用下图所示实验装置(气密性良好),验证浓硫酸、浓盐酸的挥发性。其中甲、乙、丙三个广口瓶中依次装有浓硫酸、浓氨水、浓盐酸。
已知:2NH3 + H2SO4 = (NH4)2SO4;(NH4)2SO4为白色固体。
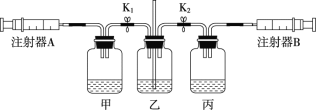
实验步骤 | 实验操作 | 实验现象 |
① | 打开K1,关闭K2,缓慢拉注射器A活塞 | 甲中液面上方无明显现象 |
② | 打开K2,关闭K1,缓慢拉注射器B活塞 | 丙中液面上方出现大量白烟 |
(1)丙中发生化合反应,生成大量白烟(NH4Cl)的化学方程式为________。
(2)该实验能够得出的结论是________。
(3)从微观角度解释甲中无白烟,而丙中出现白烟的原因是__________。