题目内容
【题目】CO2的制取和利用是热门的研究课题。

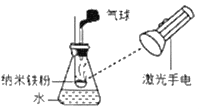
(1)实验室用图1装置制取CO2。
①反应原理用化学方程式表示为_____。
②仪器a的名称是_____,装药品时先将_____加入锥形瓶中。
③实验中证明锥形瓶中空气已排尽的方法是_____。
(2)我国最新利用CO2的有关研究成果如下。
①“可呼吸CO2”电池:使用时,Na和CO2反应生成Na2CO3和一种非金属单质。写出此反应的化学方程式:_____。
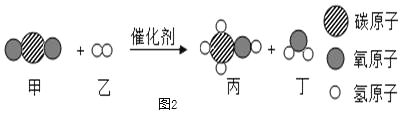
②CO2转化为甲醇:图2所示为相关反应(未配平),参加反应的甲和乙的分子个数之比为_____。
【答案】CaCO3+2HCl═CaCl2+H2O+CO2↑ 。 长颈漏斗 大理石或石灰石 将一点燃的木条放在导管口,若木条熄灭,则空气已排尽 。 4Na+3CO2═2Na2CO3+C 。 1:3 。
【解析】
(1)①实验室制取CO2是在常温下,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,故反应的化学方程式写为:CaCO3+2HCl═CaCl2+H2O+CO2↑。
②仪器a的名称是长颈漏斗,故填长颈漏斗;
实验中,应先加固体药品,再加液体药品,故填大理石或石灰石。
③实验中证明锥形瓶中空气已排尽的方法是将一点燃的木条放在导管口,若木条熄灭,则空气已排尽,故填将一点燃的木条放在导管口,若木条熄灭,则空气已排尽。
(2)①由质量守恒定律可知,Na和CO2反应生成Na2CO3和碳,故反应的化学方程式写为:4Na+3CO2═2Na2CO3+C。
②由二氧化碳高效转化为甲醇相关反应图可知,该反应的化学方程式是:CO2+3H2![]() CH3OH+H2O,参加反应的甲和乙的分子个数之比即二氧化碳和氢气的分子个数应是1:3故填1:3。
CH3OH+H2O,参加反应的甲和乙的分子个数之比即二氧化碳和氢气的分子个数应是1:3故填1:3。

 巧学巧练系列答案
巧学巧练系列答案【题目】某化学兴趣小组在探究物质燃烧条件时,做了如下实验:
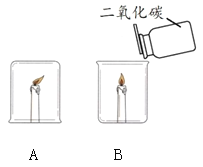
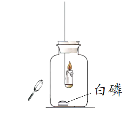
同学们发现两支蜡烛都熄灭了。
(提出问题)实验A中蜡烛熄灭的原因是什么?
(猜想与假设)
猜想1:烧杯内的氧气被耗尽,所以蜡烛熄灭。
猜想2:烧杯内的二氧化碳含量升高,所以蜡烛熄灭。
(进行实验)
实验I:点燃蜡烛,塞紧胶塞。待蜡烛熄灭后,用放大镜照射白磷。观察到白磷燃烧。
实验II:经检测,实验A中,蜡烛熄灭时,烧杯内二氧化碳的体积分数约为3%。在集气瓶中按照一定的体积比收集气体,分别放入燃烧的蜡烛和燃烧的红磷,实验记录如下:
V(O2):V(CO2) | 蜡烛 | 红磷 |
1:4 | 燃烧 | 燃烧 |
1:5 | 燃烧 | 燃烧 |
1:6 | 熄灭 | 燃烧 |
1:9 | 熄灭 | 燃烧 |
(解释与结论)
(1)实验B中蜡烛熄灭,体现二氧化碳的化学性质是_______。
(2)实验I的目的是_______。
(3)写出红磷燃烧的化学方程式_______。
(4)实验II证明猜想2错误,依据的实验现象是_______。
(5)结合实验I与实验II,得出的实验结论是_______。
(实验反思)
(6)通过此实验,同学们对物质燃烧的条件有了新的认识,如_______。
【题目】在点燃条件下,M和N反应生成X和Y。反应前后分子变化的微观示意图如下所示(其中“![]() ”代表氢原子,“
”代表氢原子,“![]() ”代表碳原子,“
”代表碳原子,“![]() ”代表氧原子)。下列叙述中,不正确的是
”代表氧原子)。下列叙述中,不正确的是
物质 | M | N | X | Y |
微观示意图 |
|
|
|
|
A.生成物均为氧化物
B.在该反应中,生成X和Y的质量比为9:22
C.M中碳、氢、氧三种元素的质量比为12:3:8
D.在该反应中,M和N两种物质的分子个数比为1:3