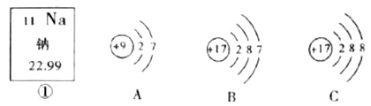
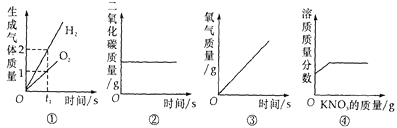
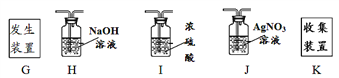
题目内容
【题目】氨氧化法制硝酸的反应原理可表示为:NH3+2O2==HNO3+H2O向反应后所得的溶液中加入定量的水可制得溶质质量分数为50%的硝酸溶液,将反应后所得的溶液脱水可制得溶质质量分数为90%的硝酸溶液。现以17t氨气为原料,反应后既不加水也不脱水,理论上可制得50%和90%的硝酸溶液的质量比为
A. 11:25 B. 14:5 C. 14:9 D. 7:5
【答案】A
【解析】氨催化氧化法制硝酸的步骤:氨气催化氧化为一氧化氮、一氧化氮和氧气反应生成二氧化氮、二氧化氮和水反应生成硝酸,将以上步骤合并得到:NH3+2O2=HNO3+H2O,根据化学方程式:NH3+2O2=HNO3+H2O,同时制得50%的硝酸m1吨和90%的硝酸m2吨时,则硝酸质量关系:0.5m1+0.9m2=63,水的质量关系:0.5m1+(1-0.9)m2=18,解得:m1=24.75吨、m2=56.25吨,所以![]() ,故选A。
,故选A。

【题目】学习酸碱盐知识后,兴趣小组同学开展了系列探究活动,请你一同参与。
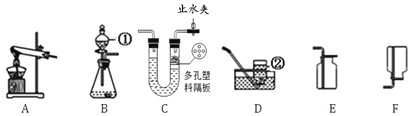
活动探究一。甲组同学为了制取饱和石灰水,利用氧化钙设计了如下实验方案。
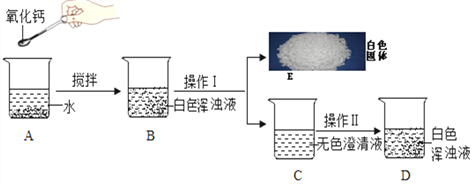
(1)A中发生反应的化学方程式为_______________________________,写出白色固体E的一种用途___________。
(2)如果要用实验证明C中不是水而是一种溶液,下列试剂无法完成实验的是___(填序号)。
①酚酞溶液 ②稀盐酸 ③二氧化碳
(3)若操作Ⅱ加入的是固体氢氧化钠(全部溶解),则产生白色浑浊的原因是___________。
活动探究二。乙组同学利用甲组制得的饱和澄清石灰水进行下图所示的实验,却未观察到预期现象。
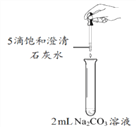
【提出问题】未观察到浑浊的原因是什么?
【猜想和假设】①与氢氧化钙溶液的浓度有关。若使用更大浓度的氢氧化钙溶液,会迅速产生浑浊。②与碳酸钠溶液的浓度有关。若使用更大浓度的碳酸钠溶液,会迅速产生浑浊。
经讨论,同学们认为猜想①不合理,其理由是__________________________。
【进行实验】乙组同学针对猜想②进行实验。
实验目的 | 实验操作 | 实验现象 | |
碳酸钠溶液浓度/% | 是否浑浊 | ||
探究猜想② | 取4支试管,向其中分别加入2mL浓度为10%、5%、1%、0.5%的碳酸钠溶液,再分别滴加5滴饱和石灰水 | 10 | 不浑浊 |
5 | 不浑浊 | ||
1 | 浑浊 | ||
0.5 | 浑浊 | ||
【解释与结论】
(1)氢氧化钙溶液与碳酸钠溶液混合出现浑浊的化学方程式是_______________________.
(2)乙组实验证明:猜想②________(填“成立”或“不成立”)。
【实验反思】丙组同学对乙组所做实验中未出现浑浊的原因进行探究。设计了多组实验,其中部分同学的实验过程及结果如下:
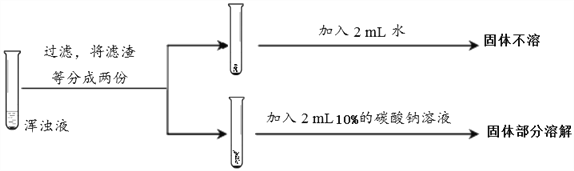
丙组同学运用的实验方法是________,得到的结论是___________________。