题目内容
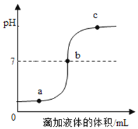
【题目】某环保小组往100g含有H2SO4和CuSO4的废水中,逐滴加入10%的NaOH溶液.测得生成Cu(OH)2沉淀质量与所加NaOH溶液质量关系如图. 下列有关说法不正确的是( )
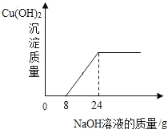
A. 与H2SO4反应的NaOH的质量为0.8g
B. 完全反应时共消耗NaOH溶液的质量为24g
C. 废水中硫酸铜的质量分数为3%
D. 100g废水中含H2SO4的质量为0.98g
【答案】C
【解析】
往含有H2SO4和CuSO4的废水中,逐滴加入的NaOH溶液时,氢氧化钠溶液先与硫酸反应,当把硫酸完全反应后,再开始与硫酸铜溶液反应,据图分析解答。
A、由图象可知,与硫酸反应的氢氧化钠溶液的质量为8g,其中含氢氧化钠的质量为:8g×10%=0.8g,说法正确;故不符合题意;
B、由图象可知,完全反应时共消耗氢氧化钠溶液的质量为24g,说法正确;故不符合题意;
C、由图象可知,与硫酸铜反应的氢氧化钠溶液的质量为16g,其中含氢氧化钠的质量为16g×10%=1.6g;设与1.6g氢氧化钠完全反应需要硫酸铜的质量为x,则
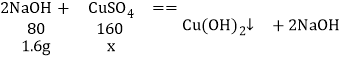
![]() 解得:x=3.2g
解得:x=3.2g
则废水中硫酸铜的质量分数为:![]() ,说法错误,故符合题意;
,说法错误,故符合题意;
D、由图象可知,与硫酸反应的氢氧化钠溶液的质量为8g,其中含有氢氧化钠的质量为8g×10%=0.8g,设与0.8g氢氧化钠完全反应需要硫酸的质量为y,则
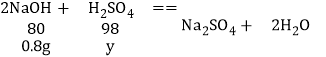
![]() ;解得:y=0.98g. 说法正确;故不符合题意;
;解得:y=0.98g. 说法正确;故不符合题意;
故选C

 阅读快车系列答案
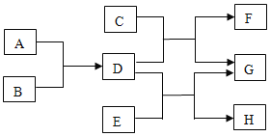
阅读快车系列答案【题目】把A、B、C、D四种物质放在密闭容器中,在一定条件下充分反应,并测得反应物和产物在反应前后各物质的质量如表所示:
物质 | A | B | C | D |
反应前质量 |
|
|
|
|
反应后质量 | 待测 |
| 0 |
|
下列说法正确的是![]()
A. 物质C一定是反应物,物质D可能是单质
B. 反应后密闭容器中A的质量为![]()
C. 反应过程中,物质B和物质D变化的质量比为87:36
D. 若物质A与物质C的相对分子质量之比为194:216,则反应中A和C的化学计量数之比为2:1
【题目】某实验小组利用石灰石残渣(杂质不溶于水也不溶于酸)制备轻质CaCO3,同时得到K2SO4,其工艺流程简要如下:
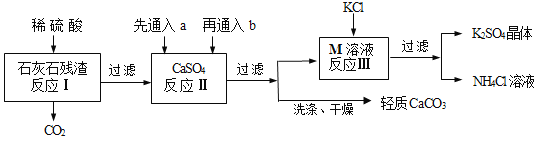
已知:CaCO3 + H2O + CO2 = Ca(HCO3)2
(1)为了提高反应Ⅰ的速率,下列措施中可行的是____(填序号);
①搅拌 ②将残渣粉碎成细小颗粒 ③适当增大硫酸的浓度
(2)反应Ⅱ中a和b分别是____(填序号);
①足量CO2、适量NH3 ②足量NH3、适量CO2
③适量CO2、足量NH3 ④适量NH3、足量CO2
(3)反应Ⅲ中相关物质的溶解度如下表,该表中M物质的化学式为____,反应Ⅲ在常温下能实现的原因是____,生成的NH4Cl溶液在农业上可用作____;
物 质 | KCl | K2SO4 | NH4Cl | M |
溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
(4)将得到的轻质CaCO3进行洗涤,判断CaCO3固体已洗涤干净的方法:取最后一次洗涤液,____(填序号),若无明显的现象,则已洗净;
①滴加稀盐酸
②滴加Na2SO4 溶液
③滴加BaCl2溶液
(5)过滤器中的滤纸折叠方法如图所示,正确的顺序是____(填序号);
(6)该工艺流程中可循环利用的物质除H2O外,还有____。