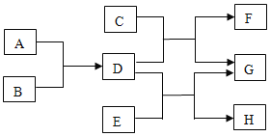
��Ŀ����
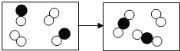
����Ŀ����֪����Ԫ�ػ��ϼ۷����仯�ķ�Ӧ��������ԭ��Ӧ�����б���ԭ��Ԫ�ػ��ϼ۽��ͣ���������Ԫ�ػ��ϼ����ߣ��������зḻ����Դ����ͼ��ʾ���ú�ˮ�ɻ���������Ʒ�������й�˵����ȷ���ǣ�������

A. �������г�ȥ�����е�SO42����Ca2+��Mg2+�����ʣ�������Լ�˳��Ϊ��NaOH��Һ��Na2CO3��Һ��BaCl2��Һ�����˺������
B. �������м�����Լ�ΪCaCl2��Һ
C. �������з���������ԭ��Ӧ
D. �ڵ���������Ԫ�ر�����
���𰸡�D
��������
A����ȥ�����е�SO42����Ca2+��Mg2+�����ʣ��ȳ���������ӣ���ҪBaCl2��Һ���ٳ�þ���ӣ���ҪNaOH��Һ�����������ӣ�����Na2CO3��Һ����ѡ�����
B�����������ʵ���ɿ�֪��Ҫ��������þ��ӦӦѡ�����ᣬ��ѡ�����
C��������ת����֪���ᾧˮ����ʧȥ�ᾧˮ�������Ȼ�þ����һ�����ʷ�Ӧ�����������ʣ������ڷֽⷴӦ������Ԫ�صĻ��ϼ�û�з����ı䣬������������ԭ��Ӧ����ѡ�����
D��������֪NaBr��Br2��NaBr����Ԫ�صĻ��ϼ�Ϊ��1�ۣ���������Ԫ�صĻ��ϼ�Ϊ0�����ڷ�Ӧ����Ԫ�صĻ��ϼ����ߣ�����Ϣ��֪��Ԫ�ر���������ѡ����ȷ����ѡD��

����Ŀ��ijʵ��С������ʯ��ʯ���������ʲ�����ˮҲ�������ᣩ�Ʊ�����CaCO3��ͬʱ�õ�K2SO4���乤�����̼�Ҫ���£�
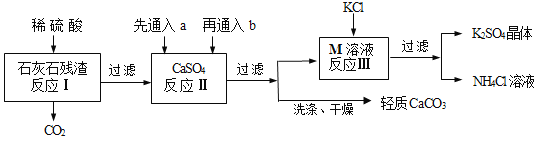
��֪��CaCO3 �� H2O �� CO2 = Ca(HCO3)2
��1��Ϊ����߷�Ӧ������ʣ����д�ʩ�п��е���____������ţ���
�ٽ��� �ڽ����������ϸС���� ���ʵ����������Ũ��
��2����Ӧ����a��b�ֱ���____������ţ���
������CO2������NH3 ������NH3������CO2
������CO2������NH3 ������NH3������CO2
��3����Ӧ����������ʵ��ܽ�����±����ñ���M���ʵĻ�ѧʽΪ____����Ӧ���ڳ�������ʵ�ֵ�ԭ����____�����ɵ�NH4Cl��Һ��ũҵ�Ͽ�����____��
�� �� | KCl | K2SO4 | NH4Cl | M |
�ܽ��/g��25�棩 | 34.0 | 11.1 | 37.2 | 19.5 |
��4�����õ�������CaCO3����ϴ�ӣ��ж�CaCO3������ϴ�Ӹɾ��ķ�����ȡ���һ��ϴ��Һ��____������ţ����������Ե���������ϴ����
�ٵμ�ϡ����
�ڵμ�Na2SO4 ��Һ
�۵μ�BaCl2��Һ
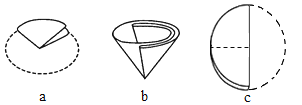
��5���������е���ֽ�۵�������ͼ��ʾ����ȷ��˳����____������ţ���
��6���ù��������п�ѭ�����õ����ʳ�H2O�⣬����____��
����Ŀ��̼���ƺ�̼�������������г������Σ�����С��ͨ������ʵ����м���
ʵ��1
ʵ����� ʵ����� | 1-1̼���� | 1-2̼������ |
| 11.96 | 8.28 |
ʵ��2
ʵ����� ʵ����� | 2-1̼������Һ | 2-2̼��������Һ |
|
| |
ʵ��3
ʵ����� ʵ����� | 3-1̼������Һ | 3-2̼��������Һ |
| ���ֽ� | 2NaHCO3�� Na2CO3 +CO2 ��+H2O |
�ش��������⣺
��1��ʵ��1�п��Ƶı�����__________��ʵ��1�ó��Ľ�����__________��
��2��ʵ��2��Ŀ����__________��
��3�� ��ʵ��3-2�й۲쵽��������__________��
����ȫ�ֽ�8.4gNaHCO3������CO2__________g��
��Ҫȷ��̼�����Ƶķֽ���������е�ʵ����__________��
����Ŀ�����й۵㶼�Ǵ���ģ������û�ѧ����ʽ����˵����
�۵� | ��ѧ����ʽ |
��������Ӧһ���ǻ��Ϸ�Ӧ | _____ |
�����κ�ˮ���ɷ�Ӧһ�����кͷ�Ӧ | _____ |
���û���Ӧһ���н������� | _____ |
������η�Ӧ������ͬʱ�������ֳ��� | _____ |
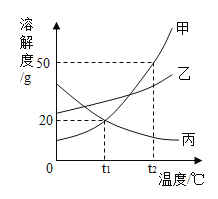
����Ŀ��20��ʱ��NaCl�ܽ�������±������������ȷ����
ʵ�� ��� | ˮ�� ����(g) | ����NaCl ������(g) | ��Һ�� ����(g) |
�� | 10.0 | 1.5 | 11.5 |
�� | 10.0 | 3.0 | 13.0 |
�� | 10.0 | 4.5 | 13.6 |
�� | 10.0 | 6.0 | 13.6 |
A. ��������Һ��������������Ϊ15.0��
B. ����������Һ�DZ�����Һ
C. 20��ʱ��NaCl ���ܽ����45.0g��100g ˮ
D. �ۢ���Һ�����������������