题目内容
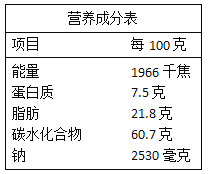
【题目】现有一瓶硫酸铜和稀硫酸的混合溶液 49.0 g,小玉向该混合溶液中逐渐滴加 10%的氢氧化钠溶液至过量。测得所加氢氧化钠溶液的质量与生成沉淀的质量关系如图所示:
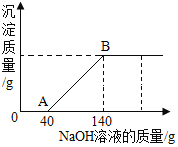
(1)与硫酸铜反应所消耗的氢氧化钠溶液的质量为____________g;
(2)请算出原混合溶液中稀硫酸的质量分数_____________。(要求写出计算过程)
【答案】10g 10%
【解析】
(1)氢氧化钠先与稀硫酸反应生成硫酸钠和水,待稀硫酸完全反应后,氢氧化钠再与硫酸铜反应生成氢氧化铜和硫酸钠,由图可知,与硫酸铜反应所消耗的氢氧化钠溶液的质量为:(140g-40g)×10%=10g;
(2)解:设原混合溶液中稀硫酸的质量分数为x
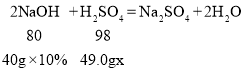
![]()
x=10%
答:原混合溶液中稀硫酸的质量分数为10%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】实验室用纯净、干燥的的氢气还原氧化铜来测定水中氢元素和氧元素的质量之比(本实验制得的氢气中可能混有氯化氢和水蒸气)。设计如下实验装置:
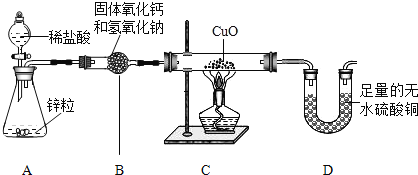
回答下列问题:
①实验开始时,应该先___________________(选填字母)。
a 给氧化铜加热 b 打开分液漏斗的活塞滴加酸液
②装置B的作用是___________________实验中若要验证氢气中混有氯化氢,该实验中改进的方法是___________________。若要避免有氯化氢气体产生,装置A中试剂应改成___________________溶液。
③装置C中的实验现象是___________________。
④反应后其数据如下表所示:
反应前 | 反应后 | |
(氧化铜+玻璃管)质量/g | 89.5 | 86.3 |
(硫酸铜+U 型管)质量/g | 214.4 | 218.0 |
根据实验数据填空,生成水中氢元素的质量为___________________克。
⑤上图中若没有装置B,并且不考虑空气中水分的影响,则测定结果中氢元素的质量会___________________(填“偏小”或“偏大”或“无影响”)。