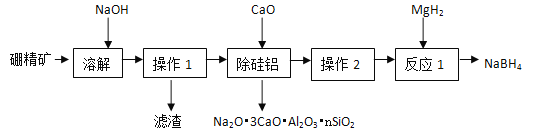
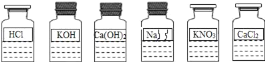
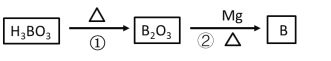题目内容
【题目】实验小组做了如下图所示实验。
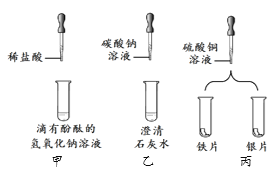
(1)能证明甲中发生反应的现象是________。
(2)乙中可观察到白色浑浊,则发生反应的化学方程式为________。
(3)丙中铁片上有红色固体析出,银片无明显变化。由该实验过程推断,金属活动性由强到弱为________。
【答案】溶液颜色由红色变为无色 ![]() Fe>Cu>Ag
Fe>Cu>Ag
【解析】
(1)氢氧化钠溶液显碱性,滴有酚酞溶液的氢氧化钠显红色,逐滴滴加稀盐酸,边滴加边搅拌,至溶液颜色由红色恰好变为无色,说明氢氧化钠已完全反应,即说明发生了反应。
(2)碳酸钠溶液能与氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:![]() 。
。
(3)丙中铁片上有红色固体析出,银片无明显变化,在金属活动性顺序中,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,说明铁的金属活动性比铜强,银的金属活动性比铜弱,即Cu>Ag;金属活动性由强到弱为Fe>Cu>Ag。
故答案为:
(1)溶液颜色由红色变为无色;
(2)![]() ;
;
(3)Fe>Cu>Ag。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
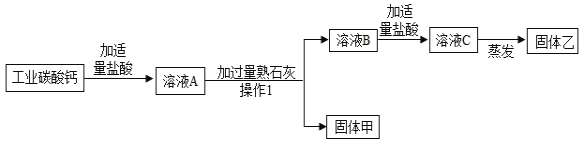
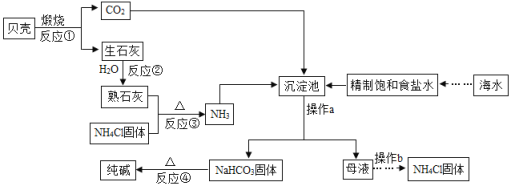
好成绩1加1期末冲刺100分系列答案【题目】在学习盐的性质时,某组同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液.同学们对该实验进行了一系列的研究.
探究一 M溶液中的溶质是什么?
(1)(提出猜想)该组同学认为M溶液的溶质有两种可能:①是 ,②是CaCl2.
(收集资料)CaCl2水溶液呈中性.
(2)(设计实验)同学们设计了如下方案并进行实验:
实验操作 | 实验现象 | 实验结论 |
取少量M溶液于试管中,向其中滴加 | | 猜想①正确,碳酸钠与其反应的化学方程式为 |
探究二 过滤后澄清滤液中会有哪些溶质?
(提出猜想)猜想一:NaOH和Na2CO3;猜想二:_____;猜想三:NaOH
(3)(实验验证)同学们针对“猜想一”进行了如下实验:
实验步骤 | 实验现象 | 实验结论 |
取样于试管中,滴入几滴稀盐酸 | 没有气体产生 | “猜想一”不成立 |
他们的实验结论是否正确? ,理由是 .
(4)(继续探究)设计实验方案确定滤液中溶质的组成.
实验操作 | 实验现象 | 实验结论 |
分别取少量滤液于A、B两支试管中,A中加入CaCI2溶液,B中加入 溶液 | 若A中产生白色沉淀,B中没有沉淀 | “猜想一”成立 |
| “猜想二”成立 | |
| “猜想三”成立 |
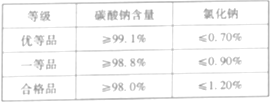
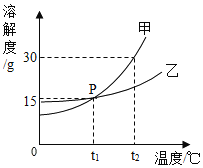
【题目】依据下列实验数据和溶解度曲线完成下面小题。
① | ② | ③ | ④ | |
温度 | 10℃ | 10℃ | 30℃ | 30℃ |
固体种类 | KNO3 | NaCl | KNO3 | NaCl |
固体质量 | 30g | 30g | 40g | 40g |
水的质量 | 100g | 100g | 100g | 100g |
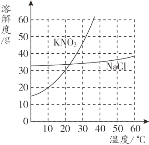
【1】①~④所得的溶液中,属于饱和溶液的是
A. ①和②B. ②和③C. ③和④D. ①和④
【2】下列说法中,正确的是
A. 溶质质量:①=②B. 溶液质量:②>③
C. 溶质质量分数:③>④D. 溶质与溶剂质量比:①=③
【题目】红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示.同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究.

提出问题:久置固体的成分是什么?
查阅资料:铁与氯化铁溶液在常温下发生反应生成氯化亚铁.
作出猜想:久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3.
实验探究:
甲同学的方案:
实验操作 | 实验现象 | 实验结论 |
取少量固体放于试管中,滴加足量的_____. | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液. | 固体中一定含有_____, 一定不含Fe2O3. |
乙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是_____.并设计如下实验方案继续验证.
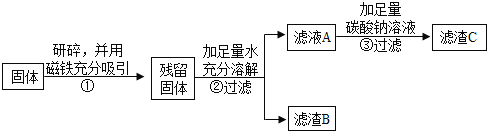
(1)②中固体溶解时放出大量热,由此可以判断固体中一定含有_____.
(2)③中反应的化学方程式是_____.
乙同学对滤渣B又进行探究.
实验操作 | 实验现象 | 实验结论 |
_____ | _____ | 固体中一定含有CaCO3 和Fe2O3. |
丙同学认为乙同学的方案中仍有一种物质不能确定.丙同学经过实验测得上述残留固体中含钙物质的总质量为1.6g,滤渣B中CaCO3的质量为1.0g,滤渣C的质量为1.0g.
综合上述实验及所给数据,久置固体的成分是_____.