题目内容
【题目】某种手机电路板中含有 Fe、Cu、Ag、Ni(镍)、Pd(钯)等金属,如图是某工厂回收部分金属的流程图。已知:2Cu+O2+2H2SO4![]() 2CuSO4+2H2O。
2CuSO4+2H2O。
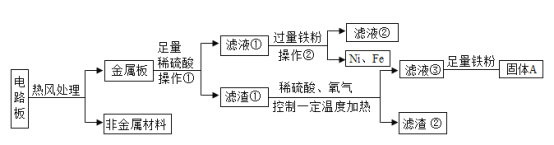
(1)操作①的名称是_____,滤液②的颜色为_____。
(2)滤渣②中含有的金属_____。
(3)写出滤液③和铁粉发生反应的化学方程式_____。
(4)Fe、Ni、Pd 在溶液中的活动性由强到弱的顺序依次是_____。
【答案】过滤 浅绿色 Ag、Pd Fe+CuSO4=FeSO4+Cu Fe>Ni>Pd
【解析】
(1)通过操作①后得滤液和滤渣,固体和液体分离,所以操作①的名称是过滤。金属板加入足量的硫酸,Fe和Ni溶于硫酸,反应后滤液①中含有过量的硫酸,还有生成的硫酸亚铁和硫酸镍,在滤液①中加入过量的铁粉,铁和硫酸反应生成硫酸亚铁,铁和硫酸镍反应也生成硫酸亚铁,所以滤液②主要溶质为硫酸亚铁,溶液颜色为浅绿色。
(2)金属板加入足量的硫酸,Cu、Ag、Pd不溶于硫酸,则滤渣①含有金属Cu、Ag、Pd,在滤渣①中加入稀硫酸和氧气,并控制一定温度加热,Cu溶解,而Ag和Pd不溶解,滤渣②中含有的金属Ag、Pd。
(3)在滤渣①中加入稀硫酸和氧气,并控制一定温度加热,Cu溶解生成硫酸铜,过滤后得到滤液③,所以滤液③主要溶质是硫酸铜,与铁粉发生反应的化学方程式Fe+CuSO4=FeSO4+Cu。
(4)Fe、Ni溶于硫酸,且铁能置换镍,则Fe>Ni,而Pd 不溶于硫酸,这三种金属在溶液中的活动性由强到弱的顺序依次是Fe>Ni>Pd。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目