题目内容
【题目】据统计:2016年,中国粗钢产量为8.084亿吨,同比增长1.2%,占世界总产量的比重达49.6%,生产了全球近一半的钢铁。请结合以下信息和所学知识,回答问题。
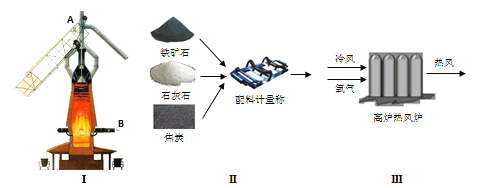
(1)工业炼铁使用图Ⅰ设备,名称是____,炼铁时将图Ⅱ中固体原料按一定配比与图Ⅲ中的富氧热空气共同投入炼铁设备中,原料的投放口为______(填“方案一”或“方案二”)。
方案一:固体原料从A口投入,热空气从B口进入;
方案二:固体原料从B口投入,热空气从A口进入;
选择此方案的优点是______。
(2)根据炼铁的原理:①先将焦炭燃烧产生CO2;②再进一步产生还原剂CO;③利用CO将赤铁矿中的铁还原出来。请写出③的化学反应方程式:______;
(3)若某炼铁厂用赤铁矿生产1吨生铁(含杂质4%),则理论上参加反应的CO为多少吨______?(请写出具体计算过程,注意格式)
(4)资料显示,若生产1吨生铁(含杂质4%),需要2.0吨赤铁矿、0.5吨焦炭以及0.3吨熔剂。某同学通过理论计算得出本次生产只需焦炭0.3吨,分析实际用量远高于理论值的原因可能有______(填字母)。
A 部分焦炭与铁相互熔合,成为生铁中的部分碳元素
B 焦炭在高温下分解
C 焦炭转变成一氧化碳后,并未全部参加反应
【答案】高炉 方案一 便于碳与氧气充分反应得到二氧化碳,二氧化碳再与碳反应得到一氧化碳 3CO+Fe2O3![]() 2Fe+3CO2 0.72t AC
2Fe+3CO2 0.72t AC
【解析】
(1)炼铁的设备是高炉,从高炉的上端投料,下端鼓入热空气,使得碳与氧气反应得到还原剂--一氧化碳;故答案:高炉;方案一;便于碳与氧气充分反应得到二氧化碳,二氧化碳再与碳反应得到一氧化碳;
(2)反应③是一氧化碳跟氧化铁在高温下反应,生成铁和二氧化碳,反应方程式为:3CO+Fe2O3![]() 2Fe+3CO2;故填:3CO+Fe2O3
2Fe+3CO2;故填:3CO+Fe2O3![]() 2Fe+3CO2;
2Fe+3CO2;
(3)解:设理论上需要一氧化碳的质量为x,则

x=0.72t
答:理论上参加反应的CO的质量为0.72t;
(4)在生铁冶炼的过程中,部分碳没有参加反应转移到的生铁中,还有部分碳生成的一氧化碳没有参加反应而损失,所以理论值小于实际用量,故填:AC。