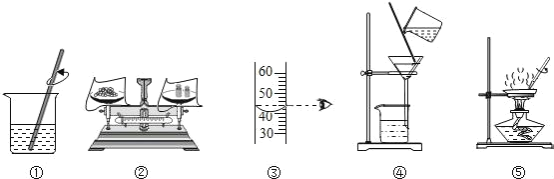
题目内容
【题目】请按照要求写出下列化学方程式,并回答问题。
(1)木炭的不完全燃烧______,该反应属于____(选填“放热”或“吸热”)反应。
(2)碳酸氢铵受热分解______,产生刺激性气味的气体可以用______试纸检验。
(3)铜丝放入硝酸银溶液中______,该反应的基本反应类型是_____。
(4)铝具有“自我保护”的化学原理是_____。
(5)利用熟石灰与硫酸铵混合研磨检验铵态氮肥______。
【答案】2C+O2![]() 2CO 放热 NH4HCO3
2CO 放热 NH4HCO3![]() NH3↑+CO2↑+H2O 湿润的红色石蕊 Cu+2AgNO3=2Ag+Cu(NO3)2 置换反应 4Al+3O2═2Al2O3 (NH4)2SO4+Ca(OH)2═CaSO4+2NH3↑+2H2O
NH3↑+CO2↑+H2O 湿润的红色石蕊 Cu+2AgNO3=2Ag+Cu(NO3)2 置换反应 4Al+3O2═2Al2O3 (NH4)2SO4+Ca(OH)2═CaSO4+2NH3↑+2H2O
【解析】
(1)碳在少量氧气中燃烧生成一氧化碳,反应的化学方程式为2C+O2![]() 2CO;该反应属于放热反应;
2CO;该反应属于放热反应;
(2)碳酸氢铵受热分解生成氨气,二氧化碳和水,该反应的化学方程式为:NH4HCO3![]() NH3↑+CO2↑+H2O;氨气是具有刺激性气味的气体,显碱性,故可以用湿润的红色石蕊试纸检验;
NH3↑+CO2↑+H2O;氨气是具有刺激性气味的气体,显碱性,故可以用湿润的红色石蕊试纸检验;
(3)铜丝放入硝酸银的溶液中,发生的反应为置换反应,故Cu+2AgNO3=2Ag+Cu(NO3)2;反应符合A(单质)+BC=B(单质)+AC的特点,故属于置换反应;
(4)铝具有很好的抗腐蚀性能,是因为铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,反应的化学方程式为:4Al+3O2═2Al2O3.
(5)硫酸铵与熟石灰混合,生成硫酸钙、氨气和水,反应的化学方程式为:(NH4)2SO4+Ca(OH)2═CaSO4+2NH3↑+2H2O;
故答案为:(1)2C+O2![]() 2CO;放热;(2)NH4HCO3
2CO;放热;(2)NH4HCO3![]() NH3↑+CO2↑+H2O;湿润的红色石蕊;(3)Cu+2AgNO3=2Ag+Cu(NO3)2;置换反应;
NH3↑+CO2↑+H2O;湿润的红色石蕊;(3)Cu+2AgNO3=2Ag+Cu(NO3)2;置换反应;
(4)4Al+3O2═2Al2O3;(5)(NH4)2SO4+Ca(OH)2═CaSO4+2NH3↑+2H2O。

【题目】小明、小芳二位同学为探究盐酸的化学性质,做了如下实验:

(1)试管A中的现象是 ,反应后试管B中一定有的阳离子是 (写离子符号)。
(2)试管C中反应的化学方程式为 。小芳同学把反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到先有气泡产生,后有白色沉淀生成。过滤,得到白色沉淀和无色滤液。
小芳同学欲探究无色滤液中的溶质成分:
小芳同学分析得出无色滤液中一定不含HCl,理由是 。
【提出问题】无色滤液的溶质是什么?
【作出猜想】①NaCl;②NaCl和CaCl2;③NaCl 、CaCl2和Na2CO3;④NaCl和Na2CO3。
小明认为猜想 一定不正确。
【进行实验】
实验步骤 | 实验现象 | 实验结论 |
①取少量滤液于试管中,滴加少量碳酸钠溶液 | 无明显现象 | 猜想 成立 |
②取少量滤液于试管中,滴加少量 | 有气泡产生 |
【题目】镁条在空气中久置表面会变黑。某小组同学设计并进行实验,探究镁条变黑的条件。
【查阅资料】常温下,亚硫酸钠(Na2SO3)可与O2发生化合反应。
【猜想与假设】常温下,镁条变黑可能与O2、CO2、水蒸气有关。
【进行实验】通过控制与镁条接触的物质,利用右图装置(镁条长度为3cm,试管容积为20mL),分别进行下列5个实验,并持续观察20天。
编号 | 主要实验操作 | 实验现象 |
1 | 先充满用NaOH浓溶液洗涤过的空气 再加入2mL浓硫酸 | 镁条始终无明显变化 |
2 | 加入2mL NaOH浓溶液 | 镁条始终无明显变化 |
3 | 先加入2mL浓硫酸 再通入约4mL CO2 | 镁条始终无明显变化 |
4 | 先加入4mL饱和Na2SO3溶液 再充满CO2 | 镁条始终无明显变化 |
5 | 先加入2mL蒸馏水 再通入约4mL CO2 | 镁条第3天开始变黑 至第20天全部变黑 |
【解释与结论】
(1)实验1和2中,NaOH浓溶液的作用是____________(用化学方程式表示)。
(2)实验1的目的是____________。
(3)实验3中,试管内的气体主要含有CO2、__________。
(4)得出“镁条变黑一定与CO2有关”结论,依据的两个实验是___________(填编号)。
(5)由上述实验可推知,镁条变黑的条件是___________。
【反思与评价】
(6)在猜想与假设时,同学们认为镁条变黑与N2无关,其理由是__________。
(7)欲进一步证明镁条表面的黑色物质中含有碳酸盐,所需要的试剂是__________。
【定量分析】小陆同学取了实验室存放较久的1克镁条和20克稀硫酸(足量)放入一支质量为30克的试管中,看到产生较多气泡,等没有气泡后精确称量,得到试管和内容物总质量为50.92克,小陆同学认为此反应产生的全部为氢气。试帮小陆同学计算这1 克镁条中还含有多少镁?
__________
同学们经过讨论一致认为在操作和称量准确的情况下,实际含有的镁要小于计算结果。请你分析可以有原因_____________________________________
【题目】实验中学化学兴趣小组为测定某石灰石样品(杂质不溶于水,也不与酸反应)中碳酸钙的质量分数,进行如图所示的实验。
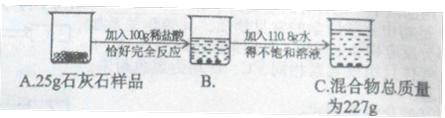
请根据以上信息计算:
(1)样品中碳酸钙的质量分数?
(2)C烧杯中溶液的溶质质量分数?
【题目】为了测定某地大理石样品中碳酸钙的含量进行了相关实验,取样品25g将200g稀盐酸分五次加入大理石样品中(杂质不溶于水也不参与反应),充分反应后测得剩余固体的总质量如下表所示:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入稀盐酸的质量/g | 40 | 40 | 40 | 40 | 40 |
剩余固体的总质量/g | 20 | 15 | 10 | 5 | 5 |
试求:
(1)20g大理石样品中杂质的质量为_____g
(2)所用稀盐酸溶质的质量分数_____?
(3)反应完全后所得溶液中溶质的质量分数_____?(写出计算过程,计算结果精确至0.1)