题目内容
【题目】某小组同学在用过氧化氢溶液与Mn02制取氧气的过程中,发现反应的速率很慢,产生的气泡很少。为此,他们进行了如下探究:
(猜想与假设)
①速度慢、气泡少可能与过氧化氢溶液的浓度有关。
②速度慢、气泡少可能与Mn02的质量有关。
(进行实验)
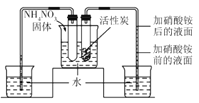
根据图甲进行如下实验。
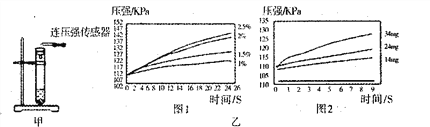
实验1:用26mg MnO2与5mL不同浓度过氧化氢溶液进行实验,压强变化如己图1。
实验2:用5mL 15%过氧化氢溶液与不同质量MnO2进行实验,压强变化如乙图2。
(解释与结论)
(l)过氧化氢溶液制取氧气的化学方程式为_________________。
(2)实验1得到的结论是___________。实验2的目的是___________ 欲得出“Mn02对过氧化氢分解有催化作用”的结论,需要对比_____________。(简要的写出实验设想)
(3)小组同学通过互联网得知:多种物质能催化过氧化氧的分解。
(实验探究)
实验证明,CuSO4溶液也能显著加快过氧化氢的分解,CuSO4溶液主要含有三种粒子(H2O、Cu2+、S042+),稀硫酸中含有三种粒子( H2O、H+、S042+)为了进一步探究CuSO4溶液中哪种粒子能起催化作用,小组同学作了以下分析和设计。
①小组同学认为最不可能的是H20,他们的理由是___________________。
②要说明另外的两种粒子是否起到催化作用,小组同学设计了如下实验,完成探究活动。
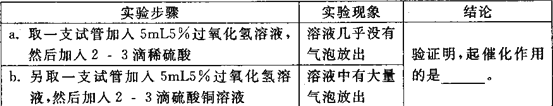 _____
_____
(反思与评价)
(4)小组同学在进行实验1和2制取氧气过程中,发现反应的速度很慢,产生的气泡很少的原因可能是_____________、______________。
(5)利用图甲装置探究“温度对过氧化氢分解速率”的影响,是否合理?_______理由是___________
【答案】 2H2O2![]() 2H2O+O2↑ 其他条件相同的情况下,过氧化氢的浓度越大,反应越快 其他条件相同的情况下,二氧化锰质量对过氧化氢分解速率的影响 过氧化氢质量分数相同,加和不加二氧化锰的两种情况下压强变化的情况 过氧化氢溶液中含有水 Cu2+ 过氧化氢的浓度低 催化剂的量太少 不合理 水受热转化为水蒸气导致气压变化
2H2O+O2↑ 其他条件相同的情况下,过氧化氢的浓度越大,反应越快 其他条件相同的情况下,二氧化锰质量对过氧化氢分解速率的影响 过氧化氢质量分数相同,加和不加二氧化锰的两种情况下压强变化的情况 过氧化氢溶液中含有水 Cu2+ 过氧化氢的浓度低 催化剂的量太少 不合理 水受热转化为水蒸气导致气压变化
【解析】(1)过氧化氢在二氧化锰作催化剂的条件下反应生成水和氧气,反应的方程式为. 2H2O2![]() 2H2O+O2↑ ;
2H2O+O2↑ ;
(2)由实验1可知,过氧化氢溶液的浓度越大,生成气体的压强越大,故说明他条件相同的情况下,过氧化氢的浓度越大,反应越快;实验2 是探究其他条件相同的情况下,二氧化锰质量对过氧化氢分解速率的影响;通过过氧化氢质量分数相同,加和不加二氧化锰的两种情况下压强变化的情况,可以得出“Mn02对过氧化氢分解有催化作用”的结论;
(3)①过氧化氢溶液中含有水,故能说明水不是该反应的催化剂;②由实验可知硫酸铜溶液中的铜离子对该反应起到了催化作用;
(4)由实验可知,过氧化氢的浓度和催化剂对反应的速率又影响,故实验中产生的气泡很少的原因可能是过氧化氢的浓度低 或催化剂的量太少 ;
(5)该方法是不合理的,因为水受热转化为水蒸气导致气压变化

 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案