题目内容
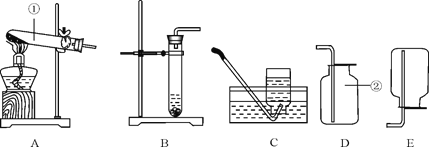
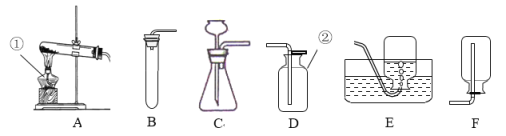
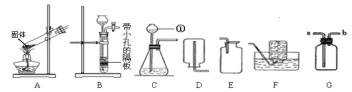
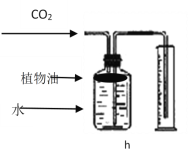
【题目】实验室制取气体的装置如下图所示,请根据所学的知识回答下列问题.
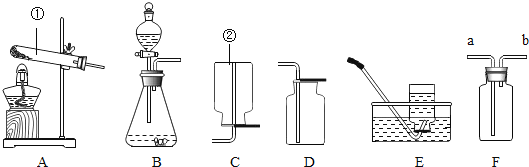
(1)写出标号仪器的名称:①___________;
(2)若用高锰酸钾加热制取氧气,应选用的发生装置是_________(填标号),该装置需要改进的地方是______________;用该装置制取3.16g高锰酸钾加热一段时间后,测出固体剩余物中钾和氧的原子个数比为1:3,则加热过程中产生氧气的质量为________g。用装置 E收集氧气的适宜时刻是________________,在实验时小明同学用该方法未能收集到两瓶氧气,其可能的原因有________(填序号)
A.没有塞紧橡皮塞 B.试管口没有放棉花
C.没有及时更换收集第二瓶 D.加热前已将集气瓶灌满水倒立于水槽中
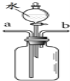
(3)若用F装置收集并测定收集到氢气的体积,首先要在F装置中________, 还需要仪器_______(填名称),该仪器应该与装置F中的_________导管相连。(选填“a”或“b”)
(4)实验室用装置B来测定某石灰石样品(固体杂质不溶于水也不与稀盐酸反应)中碳酸钙的质量分数。在锥形瓶中加入6.25g该石灰石样品,通入分液漏斗加入稀盐酸(足量)充分反应后收集到产生的气体2.2g,求a.该大理石样品中碳酸钙的质量分数是____________;b.100Kg这种石灰石样品充分煅烧后,可到固体的质量多少________Kg(碳酸钙高温分解只生成氧化钙和二氧化碳)(规范写出计算过程)
【答案】试管 A 试管口放一团棉花 0.32g 导管口有连续均匀气泡 AC 装满水 量筒 a 80% 64.8g
【解析】
(1)据图可知仪器①是试管;
(2)加热高锰酸钾制取氧气属于固体加热型,故选发生装置A;发生装置应做的改进是在试管口塞一团棉花;设反应后氧元素的质量为x,3.16g高锰酸钾中,钾元素的质量为:3.16g×![]() =0.78g,氧元素的质量为:3.16g×
=0.78g,氧元素的质量为:3.16g×![]() =1.28g,剩余物中钾和氧的原子个数比为1:3时,锰元素和氧元素的质量比为:(39×1):(16×3)=39:48,反应前后钾元素的质量不变,则有:39:48=0.78g:x,x=0.96g,则加热过程中产生氧气的质量为:1.28g-0.96g=0.32g;A、没有塞紧橡皮塞,使氧气部分扩散到空中,收集的氧气减少,故A可选;B、试管口放有棉花,防止高锰酸钾粉末进入导管,与生成的氧气无关,故B不可选;C、没有及时更换集气瓶,使收集的氧气减少,故C可选;D、加热前已将集气瓶灌满水倒立于水槽中,不会造成生成的氧气减少,故D不可选;
=1.28g,剩余物中钾和氧的原子个数比为1:3时,锰元素和氧元素的质量比为:(39×1):(16×3)=39:48,反应前后钾元素的质量不变,则有:39:48=0.78g:x,x=0.96g,则加热过程中产生氧气的质量为:1.28g-0.96g=0.32g;A、没有塞紧橡皮塞,使氧气部分扩散到空中,收集的氧气减少,故A可选;B、试管口放有棉花,防止高锰酸钾粉末进入导管,与生成的氧气无关,故B不可选;C、没有及时更换集气瓶,使收集的氧气减少,故C可选;D、加热前已将集气瓶灌满水倒立于水槽中,不会造成生成的氧气减少,故D不可选;
(3)要测定氢气体积,首先要在F装置中装满水,还需要量取水的量筒,氢气密度比水小,所以应从短管进气,长管与量筒相连;
(4)解:a、设参加反应碳酸钙的质量为x,
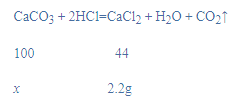
![]()
x=5g,
大理石样品中碳酸钙的质量分数=![]() 100%=80%;
100%=80%;
b、设100Kg这种石灰石样品充分煅烧后,得到二氧化碳的质量为y,
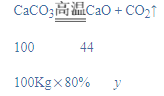
![]()
y=35.2 Kg,
可到固体的质量=100Kg-35.2 Kg=64.8 Kg。