题目内容
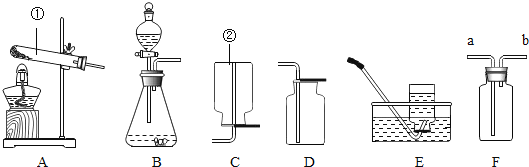
【题目】高锰酸钾是常用的氧化剂。如图是实验室模拟工业上制备高锰酸钾晶体的操作流程:

(1)操作③的名称是________,所需要的玻璃仪器是________(填一种即可);
(2)操作流程中可循环利用的物质是________;
(3)制得的高锰酸钾可用来制取氧气,该反应的化学方程式为__________。
(4)氢氧化钾、二氧化锰和氧气在高温条件下煅烧,生成锰酸钾和水,该反应的化学方程式为__________。
【答案】过滤 玻璃棒(或烧杯或漏斗) 二氧化锰 2KMnO4![]() K2MnO4+MnO2+O2↑ 4KOH+2MnO2+O2
K2MnO4+MnO2+O2↑ 4KOH+2MnO2+O2![]() 2K2MnO4+2H2O
2K2MnO4+2H2O
【解析】
(1)操作③是将高锰酸钾晶体与滤液分离,是过滤操作,故填过滤;过滤所需要的玻璃仪器有玻璃棒、烧杯、漏斗,故填玻璃棒(或烧杯或漏斗)。实验中通过操作②所析出高锰酸钾晶体,操作②是降温结晶,降低温度,高锰酸钾的溶解度减小,说明高锰酸钾的溶解度随温度升高而增大.
(2)由实验室模拟工业上制备高锰酸钾晶体的操作流程可以看出,生产过程中可循环使用的物质是二氧化锰,故填二氧化锰。
(3)高锰酸钾在加热的条件下反应生成锰酸钾、二氧化锰和氧气,故反应的化学方程式为:2KMnO4![]() K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。
(4)氢氧化钾、二氧化锰和氧气在高温条件下煅烧,生成锰酸钾和水,该反应的化学方程式为4KOH+2MnO2+O2![]() 2K2MnO4+2H2O。
2K2MnO4+2H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
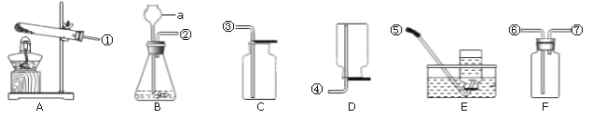
小学生10分钟应用题系列答案【题目】FeCl3(氯化铁)溶液也能对过氧化氢的分解能起催化作用,某小组拟在相同浓度FeCl3溶液的催化下,探究过氧化氢浓度对过氧化氢分解速率的影响。
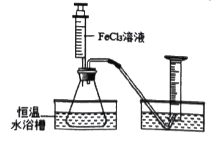
Ⅰ.分别取相同体积、不同浓度的过氧化氢溶液于锥形瓶中,注入相同体积、相同浓度的FeCl3溶液,通过观察______,就可以粗略判断,得到实验结果,为进一步判断上述试验结论的准确性,运用图示装置,小刚同学进行了如下实验方案设计进行定量研究。
Ⅱ.[方案一]在不同过氧化氢浓度下,测定收集相同体积气体所需的时间。
[方案二]在不同过氧化氢浓度下,测定_________。
方案二的实验测量结果:
物理量 序号 | H2O2溶液的浓度和体积 | 2% FeCl3溶液的 体积(mL) | 反应的时间 ( min) | 生成O2的体积 (mL) |
1 | 30%,10mL | x | 5 | V1 |
2 | 10%,10mL | 3 | y | V2 |
(1)表中x=_________,y=_______。
(2)通过测量,若V1_______V2(填“>”、“=”或“<”) 得出的实验结论为_____。