题目内容
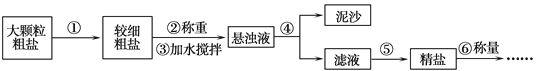
【题目】某地海水中除氯化钠外,还有氯化镁、氯化钙,为了除去杂质进行如图操作。
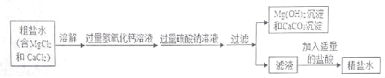
(1)上述操作中的过滤后所得的滤液中含有的溶质有_____(填化学式);
(2)滤液中加入盐酸到_____时停止;
(3)加入Ca(OH)2时发生的化学反应的化学方程式_____。
【答案】NaCl、NaOH、Na2CO3 不产生气泡 MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2
【解析】
(1)氢氧化钙和氯化镁反应生成氢氧化镁沉淀和氯化钙,和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠;上述操作中的过滤后所得的滤液中含有的溶质有:氯化钠、碳酸钠和氢氧化钙反应生成的氢氧化钠、过量的碳酸钠,化学式分别为:NaCl、NaOH、Na2CO3;
(2)滤液中加入盐酸,盐酸先和氢氧化钠反应生成氯化钠和水,后和碳酸钠反应生成氯化钠、水和二氧化碳,因此应该到不产生气泡时停止;
(3)加入Ca(OH)2时,氢氧化钙和氯化镁反应生成白色沉淀氢氧化镁和氯化钙,反应的化学方程式:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2。

练习册系列答案
相关题目