题目内容
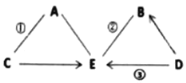
【题目】某学生设计的下列四个实验方案中,理论上正确,操作上可行,经济上合理的是( )
A. Cu![]() CuCl2
CuCl2![]() Cu(OH)2
Cu(OH)2
B. H2O![]() O2
O2![]() MgO
MgO
C. CaCO3![]() CaO
CaO![]() Ca(OH)2溶液
Ca(OH)2溶液![]() NaOH溶液
NaOH溶液
D. MgCl2![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
【答案】C
【解析】
A.根据金属的活动性可得知,铜不能与稀盐酸发生反应,因此该方案中铜与稀盐酸发生反应在理论上是不正确的,选项错误;
B.水通电分解可生成氧气,镁与氧气反应可以生成氧化镁,因此方案在理论上正确,但通过空气获得氧气要比电解水更经济,因此该方案在经济上不够合理,选项错误;
C.碳酸钙高温下分解生成的氧化钙与水反应可生成氢氧化钙,氢氧化钙溶液与碳酸钠溶液通过复分解反应,可以得到氢氧化钠溶液,此方案理论上正确,操作也较为简单可行,又可实验纯碱制得烧碱,经济上合理,选项正确;
D.氯化镁与氢氧化钠反应生成氢氧化镁沉淀,而氢氧化镁却不能分解生成金属单质镁,此方案理论上不正确,选项错误,故选C。

【题目】金属材料在国民生产和日常生活中得到普遍广泛的应用
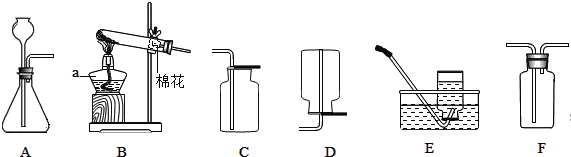
(1)用如图所示实验探究铁生锈的条件(每支试管中均放有完全相同的洁净铁片);
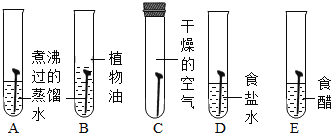
①甲同学认为,试管A发生的现象就能够说明铁的锈蚀是铁与空气中的氧气、水蒸气共同作用的结果。乙同学不同意他的观点,认为必须全面观察试管_______(选填试管编号)发生的现象,并经过科学严谨的推理,才能得出上述结论。B中植物油的作用是_______。
②试管D和E实验的目的是进一步探究铁在_______的环境中是否更容易锈蚀。
(2)黄铜(铜锌合金)用作弹壳的制造。现有一批使用过的,锈迹斑斑的弹壳,处理这批弹壳可以制得硫酸锌和铜,其主要流程如图甲所示:
(收集资料)弹壳上的锈主要为Cu2(OH)2CO3,能与稀硫酸反应得到硫酸铜溶液;弹壳中其他杂质不溶于水,也不参加反应。
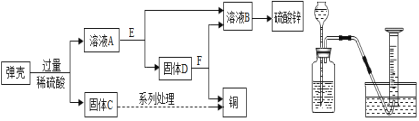
甲 乙
①写出弹壳上的锈与稀硫酸反应的化学方程式_______。
②固体D为_______。从微观的角度来看,A与E的反应微观实质是_______。
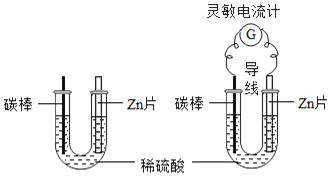
(3)为了比较甲、乙两种金属的活动性强弱和相对原子质量大小,小昊设计了一套实验装置(如图乙),他取两种金属各m克,分别加入足量的稀硫酸进行反应,在相同条件下测定不同时间内收集到的气体体积,实验记录如表:
反应时间(秒) | 20 | 40 | 60 | 80 | 100 | 120 | 140 | |
收集到的气体体积(毫升) | 甲金属 | 25 | 60 | 95 | 130 | 160 | 170 | 170 |
乙金属 | 30 | 75 | 120 | 150 | 150 | 150 | 150 | |
①由实验结果可知:金属活动性较强的是_______。实验中,除了要控制两种金属的质量相等,还需要控制的变量有_______。
②为了使得到的实验数据准确,小昊开始收集气体的时间点应该是_______(填字母)
A.导管口一有气泡冒出时 B.冒出气泡连续且均匀时C.检验产生的气体纯净时
③根据已有实验数据,要比较甲、乙两种金属的相对原子质量大小,还需知道的数据是______。
【题目】下列化学方程式与对应反应类型均正确的是( )
化学方程式 | 反应类型 | |
A | H2O | 分解反应 |
B | 4Al+3O2=2Al2O3 | 化合反应 |
C | 2Fe+6HCl═2FeCl3 +3H2↑ | 置换反应 |
D | CO2 +2NaOH ═Na2CO3+H2O | 复分解反应 |
A. AB. BC. CD. D