��Ŀ����
����Ŀ��ij��ѧ��ȤС��Ϊ�˷������������ĺ�����������ʵ���о�����ȡ60g����������������800ϡ�����4�μ��뵽����Ʒ�У�������ݼ�¼���±���
��1�� | ��2�� | ��3�� | ��4�� | |
����ϡ����������g�� | 200 | 200 | 200 | 200 |
ʣ�����������g�� | 37.6 | 15.2 | 4 | 4 |
��˵�������������ʲ�����ˮ��Ҳ�������ᷴӦ����
��1����2�β��ʣ���������Ϊ15.2g����ɷ�Ϊ_____��
A���� B������̼ C��̼
��2��������������������Ϊ���٣���д��������̣����������С�����һλ��_____
��3����������ϡ�����������������Ϊ���٣�_____��д��������̣����������С�����һλ����������Ӧ���ɵ��������������ϡ���������Ĺ�ϵͼ��_____
���𰸡�B 93.3% 19.6% 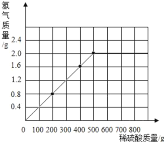
��������
��1������ͼ���ɷ�����ڶ��ε�ʣ������м����ᣬ����������٣�˵���ڶ���ʣ���������ʣ�࣬��Ȼ̼����Ӧ��Ҳʣ�࣮�ʴ�Ϊ��B
��2�����е�3����4��ʣ����嶼��4g����֪����ʣ�����4gΪ̼������������������������Ϊ��![]()
��3���ӵ�1����2���пɵó����ۣ�ÿ200g���������ȫ��Ӧ37.6g��15.2g��22.4g����
��200gϡ�����е���������Ϊx��22.4g����Ӧ��������������Ϊy��
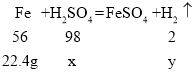
![]()
��֮�ã�x��39.2g��y��0.8g
ϡ�����������������Ϊ��![]()
�ɵó�56g����Ӧ��������������Ϊ![]() ��ǡ�÷�Ӧ���ĵ���������Ϊ500g
��ǡ�÷�Ӧ���ĵ���������Ϊ500g
�����������ᷴӦ���������������ͷ�Ӧ��500g��������ȣ�����ͼ�����£�
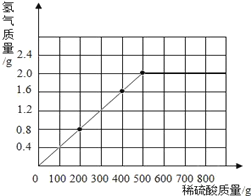
��������������������Ϊ93.3%��ϡ�����������������Ϊ19.6%��

����Ŀ��������û����������ʱ������ˮ��������Ӧ���������£�����ˮ�����ܷ�Ӧ����һ�ֳ��������������һ�����塣С���ܺ��棬�������ʵ��̽��������ˮ������Ӧ��IJ��
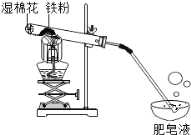
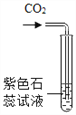
![]() �Թ�β����һ��ʪ����Ŀ����_____��
�Թ�β����һ��ʪ����Ŀ����_____��
![]() ̽�����ɵ�������ʲô��
̽�����ɵ�������ʲô��
��ȼ�ŵ�ľ�����������ݣ��б��������Ժ��з�����Ʈ�����С�˵�����ɵ�������_____��
![]() ̽���Թ���ʣ�����ɷ���ʲô��
̽���Թ���ʣ�����ɷ���ʲô��
���������ϣ�
�������������� | FeO |
|
|
��ɫ��״̬ | ��ɫ��ĩ | ����ɫ��ĩ | ��ɫ���� |
�ܷ������� | �� | �� | �� |
��������֤���Թ���ʣ�����Ϊ��ɫ����ȫ��������������
����������裩����һ��ʣ�������Fe��Fe3O4���������ʣ�������_____��
��ʵ��̽����
ʵ����� | ʵ������ | ���� |
_____ | _____ | _____ |
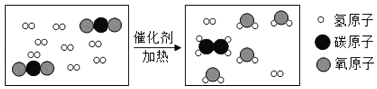
��ʵ����ۣ�����ˮ������Ӧ�Ļ�ѧ����ʽΪ_____��
����˼�뽻�����ú�ɫ���岻������Fe2O3��������_____��
����Ŀ��ij��ѧ��ȤС��Ϊ̽����ѧ��Ӧ�е������仯����������ʵ�飺
̽��һ���������������Ƶķ�Ӧ
��1����ͬѧ���ʵ�飺��һ�����������ƹ����м���20mL4%���ᣬ���¶ȼƷ�Ӧ����Һ�¶����ߣ��ó��кͷ�Ӧ���ȡ���ͬѧ��Ϊ��ʵ�鷽������������������_____��
��2����ͬѧ�������������ʵ�飬������������ʵ�鷽����
ʵ���� | ʵ�鷽�� |
ʵ��1 | ��20mL4%�����м���20mLˮ���ⶨϡ��ǰ����Һ���¶ȡ� |
ʵ��2 | ��20mL5%����������Һ��_____���ⶨϡ��ǰ����Һ���¶ȡ� |
ʵ��3 | _____ |
��3����ͬѧ�۲쵽��ʵ�������ǣ�ʵ��3��Һ���ߵ��¶�Զ����ʵ��1��ʵ��2��Һ���ߵ��¶�֮�ͣ��ɴ����ܵó���ʵ�������_____��
̽������������̼��������Һ�ķ�Ӧ
��ͼ�Ƕ�ͬѧ��20���������������������¶ȴ����������Ʒֱ���20mLˮ��20mL����̼��������Һ�и�����20mL13.7%������¶���ʱ��ı仯����ͼ��ʵ���ñ���̼��������Һϡ��ʱ�¶ȱ仯���ɺ��Բ��ơ��ݴ˻ش��������⣺

���ߢ٣�ˮ+������¶ȱ仯���ߣ����ߢڣ�����̼��������Һ+������¶ȱ仯����
��4��26������ߢ����½�����Ҫԭ����_____��
��5�����ߢڷ�Ӧ�Ļ�ѧ����ʽ��_____��
��6���Ƚ����ߢٺ����ߢڣ�����Ϊ13.7%�����뱥��̼��������Һ�ķ�Ӧ��_____������ȡ������ȡ�����Ӧ����������_____��