题目内容
【题目】学习了MnO2对过氧化氢分解有催化作用的知识后,某同学想:CuO能否起到类似MnO2的催化剂作用呢?于是进行了以下探究.
(猜想)
I.CuO不是催化剂、也不参与反应,反应前后质量和化学性质不变;
Ⅱ.CuO参与反应产生O2,反应前后质量和化学性质发生了改变;
Ⅲ.CuO是反应的催化剂,反应前后_____。
(实验)用天平称量0.2gCuO,取5ml 5%的过氧化氢溶液于试管中,进行如下实验:
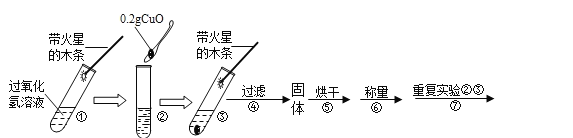
(1)填写下表:
步骤③的现象 | 步骤⑥的结果 | 步骤⑦的现象 | 结论 |
带火星的木条复燃 | _____ | _____ | 猜想Ⅰ、Ⅱ不成立,猜想Ⅲ成立 |
(2)步骤①的目的是_____,步骤⑦的目的是:_____。
(3)步骤⑥用到的主要实验仪器是_____。
(4)过氧化氢能被CuO催化分解放出O2反应的符号表达式_____。
【答案】质量和化学性质不变 0.2g 产生大量气泡,带火星木条复燃 对比实验,比较过氧化氢在有无氧化铜的情况下的分解速率 验证氧化铜反应前后的化学性质是否改变 托盘天平 H2O2![]() H2O+O2
H2O+O2
【解析】
解:[猜想]Ⅲ、催化剂的特点是“一变,两不变”,即反应速率变,质量和化学性质不变,所以猜想为:CuO是催化剂,反应前后质量和化学性质不变;
(1)氧化铜对过氧化氢的分解有催化作用,能加快其分解速率生成氧气的速率,故现象是有气泡,带火星的木条复燃;催化剂的特点是“一变,两不变”,反应前后其质量不变,所以氧化铜的质量仍为0.2g;催化剂的特点是“一变,两不变”,其中反应速率改变,这里是加快,所以现象是溶液中有气泡放出,带火星的木条复燃;
(2)为了看氧化铜是否能改变反应的速率,要通过加入氧化铜与不加氧化铜的现象进行对比,才能得出科学合理的结论:
步骤①的目的是:对比实验,比较过氧化氢在有无氧化铜的情况下的分解速率;
步骤⑦的目的是:验证氧化铜反应前后的化学性质是否改变;
(3)称量用到的主要实验仪器是托盘天平;
(4)双氧水反应生成水和氧气,过氧化氢能被CuO催化分解放出O2的反应的符号表达式为H2O2![]() H2O+O2。
H2O+O2。

 名校课堂系列答案
名校课堂系列答案【题目】某金属冶炼场在生产过程中产生了一些含铜废料。化学兴趣小组利用稀硫酸和铁粉分离回收铜,并得到硫酸亚铁晶体。

(查阅资料)
(1)在同温同压下相同体积的气体含有的分子个数相同;
(2)在通入空气和加热的条件下,铜可以和稀硫酸反应生成硫酸铜,反应的化学方程式是2Cu +2H2SO4+ O2 ![]() 2CuSO4 + 2H2O 。
2CuSO4 + 2H2O 。
(回答问题)
(1)步骤I中分离得到固体A和蓝色溶液B的操作名称是_____;
(2)蓝色溶液B的溶质是_____(填化学式);
(3)写出反应Ⅲ中发生反应的化学方程式_____;
(4)铜制品可以在空气中发生锈蚀,铜锈化学式为Cu2(OH)2CO3,根据铜锈的化学式可以判断铜锈蚀需要空气中的_____(写化学式)。
(拓展研究)
小明通过查阅资料,利用铁粉、碳粉、氯化钠等物质进行了实验(如装置图),9分钟后测得数据如下表:

实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 量气管内液面所在刻度 | 量气管内液面所在刻度 |
150.0mL | 30.8mL | 0.2mL |
(1)请计算出空气中的氧气含量_____;
(2)碳粉和氯化钠在本实验中的作用是_____;
(3)若将装置中的粗铁粉换成足量的铜粉进行实验,请判断能否比较准确的测定出空气中氧气的体积分数,请说明理由_____。
【题目】某化学兴趣小组对“空气中氧气含量的测定”展开探究。
(实验回顾)实验室常用红磷燃烧的方法测定空气中氧气的含量(如图1、图2),红磷燃烧的符号表达式为__________。兴趣小组用该方法测出的氧气含量常常远低于21%。
(实验改进)甲同学认为误差主要是由实验装置造成的,于是改用图3装置进行实验。
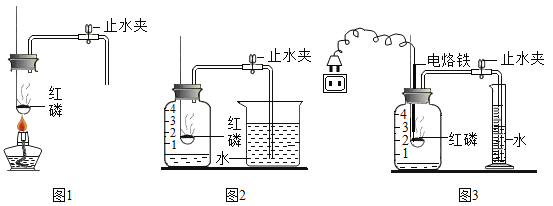
(1)按图2装置实验,实验开始前应先进行的一步操作是________________。实验中燃烧匙内盛放红磷的量必须_________。
(2)按图3装置实验,点燃红磷的方式不同于图1,而是接通电源使电烙铁发热,点燃红磷后,断开电源。与图2装置相比,图3装置使用电烙铁可以减小实验误差,其原因是____________。
(提出问题)在操作规范的情况下,用改进后的装置测得的氧气含量约为14%。为什么测量结果与真实值仍有较大差距呢?
(查阅资料)燃烧过程中当氧气体积分数低于7%时,红磷就无法继续燃烧。引起本实验的误差除装置外,还与可燃物的性质有关。
(实验探究1)乙同学利用图4装置测定空气中氧气的含量。其中与集气瓶相连的压强传感器等电子设备能将集气瓶内压强精确地记录并保存下来。图5是用该装置测得的木炭在集气瓶中燃烧的压强-时间关系图(该装置气密性良好,P0是集气瓶内初始气压,P是反应结束时恢复到室温时集气瓶内的气压)。
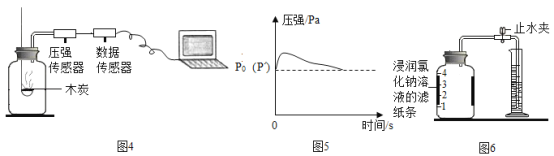
(3)反应开始时集气瓶中压强会瞬间_____(填“变大”、“变小”或“不变”),原因是___________ 。
(4)根据图5,木炭不可代替红磷测定空气中氧气含量的原因是______________。
(实验探究2)已知常温下铁与空气中的氧气、水反应生成铁锈(主要成分是Fe2O3),在有氯化钠、炭粉存在条件下,反应速度较快。丙同学根据铁生锈的原理,探究用铁能否准确测定空气中氧气的含量,设计了图6所示实验装置,8分钟后测得数据如下表:
A | 实验后的体积 | |
集气瓶内空气 | 量筒内水 | 量筒内剩余水 |
262mL | 180.0mL | 127.2mL |
(5)丙同学将铁粉、炭粉等物质不是堆在瓶底,而是撒在浸润氯化钠的滤纸条上再贴在广口瓶内侧,其目的是____________________。
(6)根据表中数据计算空气中的氧气含量____________。(写出计算过程,计算结果保留到0.1%)
(结论与反思)通过上述实验探究,选择合适的物质和实验装置进行实验,可较为快速地完成实验并减小实验误差。
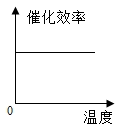
【题目】某品牌加酶洗衣粉使用方法中提示:用温水浸泡。某科学兴趣小组对该加酶洗衣粉洗涤效果与水温之间的关系进行研究,每次实验所选的衣料、奶渍的量、洗衣粉的用量和用水量均相同。在不同水温条件下,测得这种加酶洗衣粉除去衣服上奶渍所需的时间,实验结果如下表所示:
水温(℃) | 30 | 40 | 50 | 60 | 70 | 80 |
除去奶渍所需的时间(秒) | 28 | 12 | 6 | 4 | 12 | 17 |
根据表中有关数据判断,能正确表示温度对该酶催化效率影响的图象是( )
A.  B.
B. 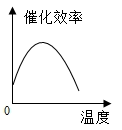 C.
C. 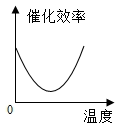 D.
D.