题目内容
【题目】相同质量的碳酸钠、碳酸氢钠、碳酸钙分别与相同质量15%的盐酸充分反应,产生二氧化碳(直接用各碳酸盐表示)大小关系有以下几种猜测:①CaCO3>Na2CO3>NaHCO3;②NaHCO3>CaCO3>Na2CO3;③CaCO3=Na2CO3=NaHCO3;④NaHCO3=CaCO3>Na2CO3;⑤NaHCO3=Na2CO3>CaCO3;⑥NaHCO3>CaCO3=Na2CO3.其中合理的为( )
A.5个B.4个C.3个D.2个
【答案】D
【解析】
碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,碳酸氢钠和稀盐酸反应生成氯化钠、水和二氧化碳。
碳酸钙、碳酸钠、碳酸镁分别与稀盐酸反应的化学方程式及有关物质的质量关系如下:
![]()
![]()
![]()
若盐酸足量,等质量的碳酸盐完全反应,产生二氧化碳的质量关系为NaHCO3>CaCO3>Na2CO3;若碳酸盐足量,等质量的盐酸完全反应,产生二氧化碳的质量关系为CaCO3=Na2CO3<NaHCO3。则正确的序号有②⑥,故选D。

【题目】除去下列物质中的杂质(括号内为杂质),所选用试剂及操作均正确的一组是( )
选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
A |
| 稀 | 加适量的稀硫酸、蒸发结晶 |
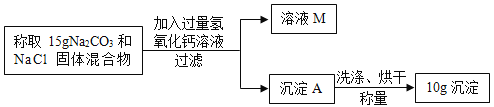
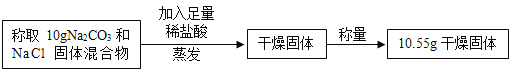
B | NaCl( |
| 加入过量 |
C |
|
稀HCl | ①加过量 ②再向沉淀中滴加适量稀盐酸 |
D | CaO( | 稀HCl | 加入足量的稀盐酸,过滤、洗涤、干燥 |
A.AB.BC.CD.D
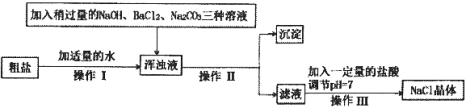
【题目】去除粗盐中难溶性杂质,利用所得精盐配制溶液,回答下列有关问题。
(1)表格中是小组同学记录的实验数据,则精盐的产率为_____;
称取粗盐/g | 5 |
剩余粗盐/g | 1 |
精盐/g | 3 |
(2)用得到的精盐配制50g6%的氯化钠溶液,配制时应选用_____mL的量筒量取水(选填“100”或“50”);
(3)在配制过程中出现下列情况,不会对质量分数造成影响的是_____。
A 量取水时仰视读数
B 氯化钠和水倒入烧杯后没有立刻搅拌
C 向细口瓶转移液体后烧杯中有残留溶液
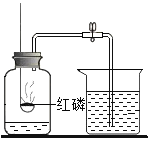
【题目】(1)实验室常用块状大理石和稀盐酸制取![]() 气体。由于某些大理石中含少量硫化物杂质,使制得的
气体。由于某些大理石中含少量硫化物杂质,使制得的![]() 中混有
中混有![]() 气体查阅资料后收集到如下信息:一、
气体查阅资料后收集到如下信息:一、![]() 能与NaOH等碱溶液、
能与NaOH等碱溶液、![]() 溶液反应,二、
溶液反应,二、![]() 中混有的HCl气体可用饱和
中混有的HCl气体可用饱和![]() 溶液吸收。
溶液吸收。
①写出实验室制取![]() 的化学方式:__________。
的化学方式:__________。
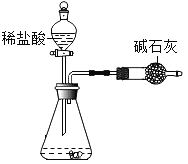
②欲获取纯净、干燥的![]() ,需对产生的气体进行除杂,实验装置如下:
,需对产生的气体进行除杂,实验装置如下:

Ⅰ.装置甲中所盛试剂应选用________(填字母)
A 浓硫酸 B NaOH溶液 C 澄清石灰水 D ![]() 溶液
溶液
Ⅱ.装置丙的作用是________,该装置所盛试剂为________。
(2)某同学进行如图的两个实验,请回答以下问题:
①甲实验中反应的化学方程式为_______________;
②乙实验观察到的现象是______________,溶液由蓝色变成无色;
③把甲、乙反应后的溶液倒入同一烧怀,发现有白色沉淀生成。他决定对白色沉淀的成分进行探究。
(查阅资料)硫酸钡不溶于酸
(提出猜想)白色沉淀为:Ⅰ._______;
甲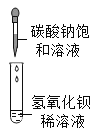 乙
乙
Ⅱ.![]() 和
和![]() ;Ⅲ.
;Ⅲ.![]() 和
和![]()
(实验方案)
实验操作 | 实验现象与结论 |
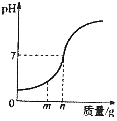
过滤。洗涤白色沉淀备用:向白色沉淀中加入盐酸至过量 | ①若沉淀全部溶解,且无其它现象,猜想Ⅰ成立 ②若________且无气体产生,猜想Ⅱ成立。 ③若沉淀完全溶解,________,猜想Ⅲ成立。 |
(拓展与思考)如果猜想Ⅲ成立,产生此结果的原因是做甲实验时________;上述白色沉淀的成分不可能出现的组合是![]() 、
、![]() 和
和![]() 原因是_________。
原因是_________。
【题目】下列实验设计能达到实验目的的是( )
选项 | 实验目的 | 实验设计 |
A | 除去CO中的少量 | 先通过浓硫酸再通过氢氧化钠溶液 |
B | 除去铁粉中的铜粉 | 加入足量的稀 |
C | 除去 | 加入适量的 |
D | 鉴别 | 加入适量 |
A.AB.BC.CD.D