题目内容
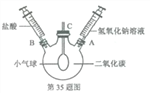
【题目】某兴趣小组用使用块状石灰石和稀盐酸制取二氧化碳。当观察不到有气泡产生,发现固体仍有剩余。
[提出问题]剩余液中的溶质是什么物质?
[作出猜想]根据实验室制取二氧化碳的反应原理_________________ (填化学方程式),同学们一致认为剩余液中一定有CaCl2,小芳认为废液中的溶质还可能含有_____________(填化学式)。
[查阅资料]CaCl2溶液呈中性。
[实验探究]
(1)小芳为了证明自己的猜想是正确的,选择pH试纸进行实验。取上层清液,用pH试纸测得溶液的pH=2,说明溶液显___________性;pH测定中,“上层清液滴到试纸上”的后一步操作是_______________________。
(2)小明选择了另外一种物质进行实验,也得到了与小芳同样的结论,他所选用的物质可能是_____________。
[交流讨论]
(3)小芳将反应后的剩余混合液加热,冷却后,取上层清液测pH,发现pH值略有上升,请简述产生此现象的可能原因____________________________。
(4)若想要处理剩余液得到只含CaCl2一种溶质的溶液,小芳选择向剩余液中加入过量的________________ (填选项序号),反应完成后过滤。
A.碳酸钙粉末 B.氢氧化钠 C.熟石灰 D.生石灰
[拓展应用] 利用传感器对二氧化碳性质再探究。
步骤1:如图1所示装置的气密性良好,三瓶250mL的烧瓶内收集满CO2气体,三个注射器内各装有等体积的液体(分别是水、饱和石灰水、氢氧化钠浓溶液)。连接好装置和压强传感器。
步骤2:三位同学同时迅速将注射器内等体积的液体(水、饱和石灰水、氢氧化钠浓溶液)注入各自烧瓶中,关闭活塞。
步骤3:一段时间后,同时振荡烧瓶。观察传感器定量实时地传回烧瓶内气压变化形成的图像情况如图2所示。

(1)导致曲线1中CD段气压急速减小的操作是:____________________。利用现有的装置,在不使用其他试剂的情况下,请你写出继续降低E点的操作方法:___________。
(2)曲线2与曲线3差异较大的原因是_________________________。
【答案】 CaCO3 + 2HCl==CaCl2 + H2O + CO2↑ HCl 酸 与标准比色卡对比,读出pH 紫色的石蕊 剩余液中氯化氢挥发 A 振荡 使烧瓶内物质冷却(或抽气) 饱和石灰水浓度太低(氢氧化钙微溶于水)影响了二氧化碳的吸收
【解析】本题考查了实验探究物质的组成成分,探究二氧化碳的性质,酸的化学性质,溶液的酸碱性与pH值的关系等。难度不大,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
作出猜想:碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3 + 2HCl==CaCl2 + H2O + CO2↑,盐酸可能过量,所以废液中的溶质还可能含有HCl;
实验探究:
(1)小花为了证明自己的猜想是正确的,选择pH试纸进行实验。取上层清液,用pH试纸测得溶液的pH=2,说明溶液显酸性;pH测定中,“上层清液滴到试纸上”的后一步操作是:将试纸显示颜色与标准比色卡对照,读出pH;
(2)紫色的石蕊遇酸性溶液变红,可用来检验酸性物质。小明选择了另外一种物质进行实验,也得到了与小芳同样的结论,他所选用的物质可能是紫色的石蕊;
(3)盐酸具有挥发性。将反应后的剩余混合物加热至沸,冷却后,取上层清液测pH,发现pH值略有上升,产生此现象的可能原因是:剩余液中氯化氢挥发,溶液中的酸性物质减少;
(4)碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,氧化钙和水反应生成氢氧化钙,过量的氢氧化钙、氢氧化钠对于氯化钙来说仍是杂质,所以想要处理剩余液得到只含CaCl2一种溶质的溶液,小花选择向剩余液中加入过量的碳酸钙,反应完成后过滤,故选A;
拓展应用:
(1)振荡烧瓶会加快二氧化碳的溶解,瓶内气压急速减小,将烧瓶内物质冷却(或抽气),能使瓶内压强继续减小;
(2)饱和氢氧化钙溶液中含有氢氧化钙的量很少,会影响二氧化碳的吸收。曲线2与曲线3差异较大的原因是石灰水浓度太低(氢氧化钙微溶于水)影响了二氧化碳的吸收。

 优学名师名题系列答案
优学名师名题系列答案