题目内容
【题目】多角度认识硫化氢气体
硫化氢( H2S)在化学研究和化工生产中有着广泛应用。道尔顿等科学家对它进行过深入研究。请认真阅读下列资料,并结合你学过的知识,回答问题(I)~(4):
资料一:硫化氩是一种无色、有臭鸡蛋气味的剧毒气体,密度比空气大,能溶于水,其水溶液称为氢硫酸,具有酸的通性。实验室中用硫化亚铁( FeS)与稀硫酸反应制取硫化氢气体。
资料二:道尔顿在其著作《新系统》中时硫化氢的研究有以下记载(大意);
A.硫化氲在密闭容器中受热,生成硫和与硫化氢等体积的氢气;
B.常温常压下,硫化氢与氧气按2:1的体积比混合,点燃,生成硫和水,无气体剩余;
C.常温常压下,硫化氢与氧气按2:3的体积比混合,点燃,恰好完全反应生成二氧化硫气体和水。
资料三:在相同温度和压强下,气体的体积之比等于分子个数之比。
(1)从宏观上看,硫化氢由____组成:从微观上看,硫化氢是由____构成。
(2)氢硫酸有酸性的本质原因是______,资料一和二中描述的硫化氢的化学性质还有______、________、______。
(3)资料二的实验B中发生反应的化学方程式_________,C实验中反应前后气体的体积比为____,B、C实验中硫化氢均发生____反应。
(4)宴验室用图3所示的装置制取并探究硫化氢气体的性质。
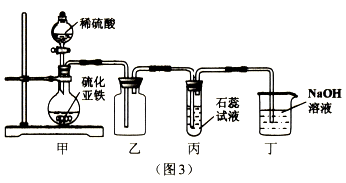
①甲装置中发生反应的化学方程式为___________;
②实验中收集气体的方法是____;
③实验中,丙装置观察到的实验现象是______________;
④丁装置的作用是____,反应的化学方程式为_____________,反应的实质是________。
【答案】(1)氢元素、硫元素(或H、S) 硫化氧分子(或H2S分子、或分子)
(2)氢硫酸溶液中存在氢离子(或硫化氢溶于水能够解离(电离)出H+)
剧毒 不稳定性(或受热能分解成硫和氧气) 可燃性(或在点燃的条件下能与氧气反应)
(3) 2H2S+O2![]() 2S+2H2O 5 :2 氧化
2S+2H2O 5 :2 氧化
(4) ①FeS+H2SO4=FeSO4十H2S↑ ②向上排空气集气法 ③试液由紫色变为红色(或溶液变成红色)
④吸收多余的硫化氢气体(或防止剧毒的硫化氢气体扩散到空气中)
H2S+2NaOH=Na2S+2H2O 氢离了和氧氧根离子结合生成水(或H++OH-= H2O)
【解析】(1)从宏观上看,硫化氢由氢元素、硫元素组组成:从微观上看,硫化氢是由硫化氢分子构成。
(2)氢硫酸有酸性的本质原因是溶于水产生的阳离子只有氢离子,必须经化学变化才能表现的性质叫化学性质,不需要发生化学变化就能表现的性质叫物理性质。硫化氢的化学性质还有剧毒、不稳定性(或受热能分解成硫和氧气)、可燃性(或在点燃的条件下能与氧气反应); (3)资料二的实验B中发生反应:硫化氢与氧气按2:1的体积比混合,点燃,生成硫和水,化学方程式2H2S+O2点燃2S+2H2O,C实验中硫化氢与氧气按2:3的体积比混合,点燃,恰好完全反应生成二氧化硫气体和水,反应方程式为:2H2S+3O2点燃2SO2+2H2O;反应前后气体的体积比为5:2,B、C实验中硫化氢均发生氧化反应。(4) ①稀硫酸和硫化亚铁常温下反应生成硫化氢和硫酸亚铁,反应方程式为FeS+H2SO4=FeSO4十H2S↑ ②硫化氢能溶于水,密度比空气大,应该用向上排空气集气法收集; ③硫化氢溶液呈酸性,能使紫色石蕊试液变成红色。④硫化氢气体有剧毒,所以要吸收多余的硫化氢气体(或防止剧毒的硫化氢气体扩散到空气中),根据硫化氢溶液显酸性,可知可以用氢氧化钠溶液吸收;反应方程式为:H2S+2NaOH=Na2S+2H2O 。二者的反应是酸碱中和反应,实质是 氢离了和氧氧根离子结合生成水(或H++OH-= H2O);

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案