题目内容
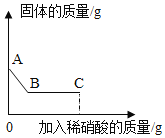
【题目】如图为A、B、C三种物质的溶解度曲线,据图回答:
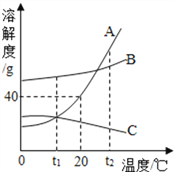
(1)t2℃时,A、B、C三种物质的溶解度由大到小的顺序___________。
(2)20℃时,将50g A物质放入100g水中,充分搅拌,所得溶液的溶质质量分数是____________。(只列计算式)
(3)将t2℃时三种物质等质量的饱和溶液分别降温到0℃时,析出溶质最多的是_____。
(4)若将t2℃时A、C两种物质的饱和溶液分别降温到t1℃,则t1℃时两种溶液中溶质的质量分数为A________C(选填“>”“<”或“=”)
(5)若A的饱和溶液中混有少量B,提纯A的方法是_________。
【答案】 A>B>C 40g/140g×100% A > 降温结晶,过滤
【解析】(1)从t2向上做垂线,与曲线的交点在上面的溶解度就大,所以t2℃时它们的溶解度大小顺序是A>B>C;(2)20℃时,A物质的溶解度是40g,说明100g水中最多溶解40g,所以将50gA物质放入100g水中所得溶液,所以所得溶液质量为40g+100g=140g,所得溶液的溶质质量分数是:40g/140g×100%;(3)由曲线图可看出三物质中A、B两物质的溶解度都随温度升高而增大,而A受温度影响较大,C物质的溶解度随温度升高而减小,当将三种物质等质量的饱和溶液分别从t2℃时降温到0℃时,A、B析出晶体,但A析出晶体多,C没有晶体析出;(4)C的溶解度随温度升高而减小,AB的溶解度随温度升高而增大,若将t1℃三种物质的饱和溶液分别升温到t2℃时,AB溶解度增大,溶质的质量分数不变,C的溶解度减小,析出晶体,据饱和溶液中质量分数的计算式,可知溶解度越大质量分数也就越大,而t1℃B的溶解度大于A的溶解度大于t2℃C的溶解度,则三种溶液中溶质的质量分数由大到小的顺序是B>A>C;(5)如果溶解度受温度影响较大的物质从溶液中结晶析出的方法是冷却热饱和溶液,如果溶解度受温度影响不大的物质从溶液中结晶析出的方法是蒸发溶剂,由于A的溶解度随温度变化比较大,所以用降温结晶的方法。

 寒假学与练系列答案
寒假学与练系列答案【题目】某化学兴趣小组为了测定石灰石样品中碳酸钙的质量分数,将 200g 稀盐酸平均分成 4 等分,分别加入样品中,充分反应后称得生成气体质量,得到的实验数据如下:
第一次 | 第二次 | 第三次 | 第四次 | |
样品质量(g) | 5 | 10 | 15 | 20 |
稀盐酸质量(g) | 50 | 50 | 50 | 50 |
生成气体质量(g) | 1.76 | 3.52 | 4.4 | m |
(1)表中 m= 。
(2)第一次反应后所得溶液中的溶质是 (填化学式)。
(3)计算该石灰石样品中碳酸钙的质量分数 ?
【题目】在一个密闭容器中有X、Y、Z、W四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:
物质 | X | Y | Z | W |
反应前质量 | 10 | 1 | 45 | 5 |
反应后质量 | 7 | 待测 | 5 | 16 |
下列说法正确的是( )
A.该反应为分解反应
B.反应中生成W的质量为16g
C.反应后Y的质量为33g
D.若Z、W的相对分子质量之比为20:11,则反应中Z与W的化学计量数之比是1:2